fælles Ioneffekt
videnskab > Kemi > Fysisk Kemi > Ionlig ligevægt > div> common Ion effect
i denne artikel skal vi studere den fælles ioneffekt og dens anvendelser.
fænomenet, hvor graden af dissociation af enhver svag elektrolyt undertrykkes ved at tilføje en lille mængde stærk elektrolyt indeholdende en fælles ion kaldes en fælles ioneffekt.
eksempel-1: (Dissociation af en Svagsyre)
ionisering af svag elektrolyt eddikesyre (CH3COOH)undertrykkes ved tilsætning af stærk elektrolyt natriumacetat (CH3COONa)indeholdende almindelig acetation (CH3COO–)
forklaring:
Antag, at en elektrolyt eddikesyre (CH3COOH) erbehandlet med vand. Det dissocierer og en ligevægt eksisterersom følger,
CH3COOH(AK) ch3coo–(AK) + H+(AK)
Ved at anvende loven om masseaktion,
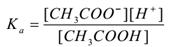
hvor ‘Ka’ er dissociationskonstanten af syre.
Hvis en lille mængde af en stærk elektrolyt som natriumacetat (CH3COONa) tilsættes til den vandige opløsning af CH3COOH, bliver den dissocieret og ligevægt eksisterer, da
CH3COONa(AK) ch3coo–(AK) + Na+(AK)
Her er CH3COO– ioner almindelige, hvorfor deres koncentration stiger. Ifølge Le-Chateliers princip skifter ligevægt mod venstre. For at holde værdien af Ka konstant øges koncentrationen af CH3COOH-molekyler. På denne måde undertrykkes ionisering af CH3COOH ved tilsætning af CH3COONa. Således øges opløsningens pH.
eksempel – 2: (Dissociation af en Svagbase):
ionisering af svagt Elektrolytammoniumhydroksid (NH4OH)undertrykkes ved tilsætning af stærkt elektrolytammoniumchlorid (NH4Cl) indeholdendefælles ammoniumion (NH4+)
forklaring:
Antag, at et elektrolytammoniumhydroksid (NH4OH)behandles med vand. Det dissocierer og en ligevægt eksisterersom følger,
NH4OH(AK) til NH4+(AK) + OH–(AK)
Ved at anvende loven om masseaktion,
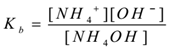
hvor ‘KB’ er dissociationskonstant af basen.
Hvis en lille mængde af en stærk elektrolyt som ammoniumchlorid (NH4Cl) tilsættes til den vandige opløsning af NH4OH, bliver den dissocieret, og der findes ligevægt, da
NH4Cl(AK) til NH4+(AK) + Cl–(AK)
Her er NH4+ ioner almindelige, hvorfor deres koncentration stiger. Ifølge Le-Chateliers princip skifter ligevægt mod venstre. For at holde værdien af Kb konstant øges koncentrationen af NH4OH molekyler. På denne måde undertrykkes ionisering af NH4OH ved tilsætning af NH4Cl. Således falder opløsningens pH.
anvendelser af fælles Ion effekt:
oprensning af almindeligt Salt:
princip:
tilsætningen af fælles ion til en mættet saltopløsning forårsager udfældning af salt. Når det Ioniske produkt overstiger opløselighedsproduktet, finder udfældning sted.
Processog forklaring:
en mættet opløsning af almindeligt salt, fri frasuspenderede urenheder tages, og HCl-gas ledes gennem den. Hvis ren HCI-gas ledes gennem denne opløsning, idet den er stærk elektrolyt, dissocierer den næsten fuldstændigt og ligevægt eksisterer,
HCl(AK) ch+(AK) + Cl–(AK)
nu Cl– er en almindelig ion. Koncentrationen af CI-ioner (almindelige ioner) øges. I henhold Tille-Chateliers princip skifter ligevægt mod venstre. Dissociation af NaCI undertrykkes, og ren naci udfældes som solidsalt. Således kan ren NaCI udfældes ved at passere HCI-gas imættet opløsning af uren naci.
saltning ud af sæbe:
princip:
tilsætningen af fælles ion til en mættet saltopløsning forårsager udfældning af salt. Når det Ioniske produkt overstiger opløselighedsproduktet, finder udfældning sted.
Processog forklaring:
sæbe er natriumsalt af højere fedtsyrer(RCOONa). Det fremstilles ved hydrolyse af olier med NaOH. Hvis der tilsættes en lille mængde NaCl til den mættede sæbeopløsning, dissocieres den som
NaCl(AK) liter Na+(AK) + Cl–(AK)
koncentration af Na+ ioner (almindelig ion) stiger. På grund af den almindelige ioneffekt reduceres dissociation af sæbe, og sæbe udfældes og kan derefter let fjernes fra sæbeopløsningen. Denne proces med at få fast sæbe fra sæbeopløsning ved at tilsætte salt som NaCI kaldes saltning ud af sæbe.