Slabý v Kolenou: Miller-Fisher Syndrom
Miller Fisherův syndrom (MFS), vzácný, self-limiting varianta syndromu Guillain-Barré syndrom (GBS), je anti-GQ1bIgG protilátek syndrom, který postihuje periferní a centrální nervové soustavy.1 akutní neuromuskulární polyneuropatický stav, MFS způsobuje vzestupnou paralýzu s klasickou prezentační triádou oftalmoplegie, ataxie a areflexie. Vědci poprvé popsali klinickou triádu v roce 1932.1 o dvě desetiletí později Kanadský specialista na mrtvici Charles Miller Fisher jako první zveřejnil zprávu v roce 1956, která popsala klinické nálezy a definovala stav jako omezenou formu GBS.2
příznaky se objevují po několik dní, často v zimě a na jaře, obvykle po virové infekci, a pacienti často pociťují diplopii jako jeden z prvních příznaků. Když pacient s příznaky jako občasné esotropií, zhoršené horizontální pronásledování a pevné mydriatické zornice, a vaše neurologické vyšetření je abnormální, je čas přemýšlet o GBS, konkrétně MFS. Následující případ ilustruje příslušné příznaky a symptomy a odráží typický výsledek.
Historie
27-rok-starý Běloch prezentovány na VA Oční Klinice během jarních měsíců vykazování akutní nástup binokulární diplopie, který začal jednoho dne předchozího. Pacient uvedl, že je konstantní, ale vyskytuje se pouze při pozorování na dálku s objekty posunutými vodorovně. S diplopií nebyla spojena žádná bolest očí ani rozmazané vidění. Stěžoval si také na nedávné závratě a potíže s rovnováhou. Hlásil sinusovou infekci s významnou paranazální kongescí, která začala týden před dvojitým viděním. Předchozí oční a lékařské historie byly všední; pacient v současné době neužíval žádné léky a neměl žádné alergie na léky.
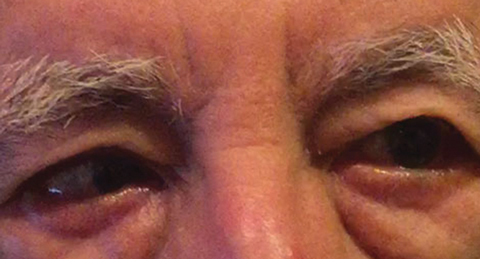
obr. 1. Diferenciální diagnóza po základním vyšetření zahrnovala částečnou pravou obrnu CN VI, což by mohlo naznačovat cévní stav, jak je vidět u jiného pacienta. Klikněte na obrázek pro zvětšení. Foto: Michael DelGiodice, OD
Diagnostická Data
Na vstupní vyšetření, nekorigované zrakové acuities byly 20/20-2 OD a 20/25-2 OS. Žáci byli 5 mm stejně kulatí a reagovali na světlo bez aferentní pupilární vady. Extraokulární pohyby byly plné, hladké a přesné v obou očích bez omezení. Krycí test na dálku odhalil přerušovanou čtyři až šest hranolových dioptrií pravé esotropie v primárním pohledu vyskytujícím se přibližně 50% času. Provedení krycího testu v near odhalilo čtyři hranolové dioptrické esophorie v primárním pohledu bez tropie.
i když se v tomto případě neprovádí, lékaři by měli pokrýt test v primárním, pravém a levém pohledu. U pacientů s diplopií se obrna lebečního nervu six (CN VI) projeví jako nekomitantní odchylka, horší v pravém nebo levém pohledu, v závislosti na tom, na které straně je obrna. Dekompenzující phoria bude na druhé straně vykazovat komitivní odchylku.
refrakční chyba byla -0,50 d koule od A -0,75 d koule OS a vidění bylo opravitelné na 20/20 v každém oku. Nitrooční tlaky byly v normálních mezích v obou očích. Nálezy předního a zadního segmentu byly v pravém a levém oku všední. Optické nervy vypadaly zdravě s poměrem pohár-disk 0,15 v obou očích.
Diferenciální diagnózy zahrnuty částečnou pravdu KN VI obrna (Obrázek 1), myasthenia gravis, tlakové proces a probíhá vzdálenost esophoria způsobuje přerušovaný právo esotropií. Pacient popřel jakoukoli předchozí anamnézu binokulární diplopie.
Zobrazování mozku a drahách, bylo objednáno oční klinika vyloučit zapojení mozku, včetně tlakové léze. Počítačová tomografie (CT) skenování mozku a oběžné dráhy byly provedeny a interpretovány neuroradiologem personálu. CT bylo vybráno místo zobrazování magnetickou rezonancí (MRI) kvůli načasování a dostupnosti; testování a výsledky bylo možné získat ve stejný den s CT na klinice po hodinách. Výsledky byly všední bez známek intrakraniálního krvácení, kompresivní léze nebo akutního infarktu.
CT paranazálních dutin odhalilo středně těžké až těžké chronické paranazální sinusové onemocnění a úplné zakalení pravého maxilárního sinusu. Na oběžnou dráhu nedošlo k žádnému rozšíření. Pacientova rodina lékař byl informován, symptomy pacienta, vyšetření očí zjištění a výsledky CT a začal ošetření pro čelistní zánět vedlejších nosních dutin ústní azithromycin pět-denní dávka balení a instruoval pacienta sledovat s oční klinika.
pacient Se vrátil o pět dní později po dokončení jeho ústní azithromycin kurz a uvedla, že nezaznamenala žádné zlepšení v dálce diplopie; kromě toho, že zažil nástup významný fotofobie a periokulární bolest kolem obou očí. Pacient uvedl, že jeho nerovnováha chůze a potíže s chůzí se také zhoršovaly. Při vyšetření zůstaly nejlépe korigované zrakové ostrosti 20/20 v pravém a levém oku. Zornice byly rozšířeny o 8,5 mm bez reaktivity na světlo v obou očích (Obrázek 2). Okohybné motilities odhalil boční omezení bolesti při pohybu v pravém oku a mediální omezení bolesti při pohybu v levém oku v souladu s právem pohled obrna (Obrázek 3). Horizontální a vertikální pronásledování bylo sakcadické s nepřesnými a trhavými pohyby. Nálezy předního a zadního segmentu zůstaly nezanedbatelné OU.
Diferenciální diagnózy po oftalmologické vyšetření zahrnuty vlevo internuclear oftalmoplegie, vpravo pohled obrna a pravý pohled s obrnou levé internuclear oftalmoplegie, které by mohly účet pro okohybné pohyblivost zjištění. Mezi další diferenciály patří léze středního mozku nebo myasthenia gravis. Diferenciální diagnózy dilatace žáků zahrnují obrnu třetího nervu (CN III), trauma a farmakologickou dilataci. Pacient neměl žádné další nálezy konzistentní s třetí nervovou obrnou a popřel trauma nebo expozici farmakologickým látkám.
pacient byl předán neurologii k dalšímu posouzení. Neurologické vyšetření hlásilo, že pacient byl plně ostražitý a orientovaný bez ztráty citlivosti obličeje. Pacient vykazoval mírnou ataxii s obtížemi chůze v tandemu a stojící z dřepu. Byla přítomna proximální slabost horních i dolních končetin a abnormální reflexe. Všechny smyslové modality byly neporušené. MRI a magnetická rezonanční angiografie (MRA) mozku a oběžné dráhy byly všední. Protein mozkomíšního moku byl zvýšen při dávce 75 mg / dL (referenční rozmezí: 15 mg/dL až 45 mg/dL) bez dalších abnormalit. Testování elektromyogramu bylo všední a nevykazovalo žádné abnormality v nervovém vedení od páteře po nohy a ruce.
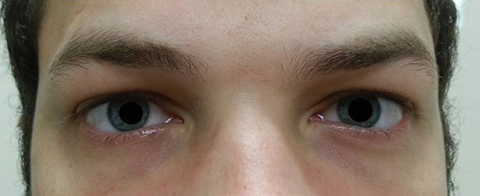
Obr. 2. Zornice pacienta byly rozšířeny o 8,5 mm bez reaktivity v pravém nebo levém oku. Klikněte na obrázek pro zvětšení.
diagnóza
pacient vykazoval akutní příznaky diplopie, ataxie a areflexie. Vzhledem k občasné právo esotropií, zhoršené horizontální pronásledování, pevné mydriatické zornice, mírná ataxie, abnormální reflexy na neurologické vyšetření a zvýšené mozkomíšním moku bílkovina, diagnóza MFS byla provedena. Pacient byl přijat do nemocnice, aby sledoval další komplikace. Pacientovi byla poskytnuta oční náplast, která pokryje pravé oko podle potřeby pro diplopii.
v současné době neexistují žádná publikovaná diagnostická kritéria pro Millerův Fisherův syndrom. Diagnóza se obvykle provádí prezentací klinické triády spolu se zobrazováním a studiemi mozkomíšního moku. MRI je obvykle ve stavu všední, i když některé studie prokázaly centrální léze ve středním mozku, pons a dolní dřeně. Elektrofyziologické studie ukazují snížené nebo abnormální periferní smyslové vedení.17
protein mozkomíšního moku je často zvýšený bez dalších abnormálních nálezů. V mezníkové studii vykazovalo 64,4% pacientů s MFS zvýšený protein míchy.8 pozitivní test anti-GQ1b IgG protilátek umožňuje definitivní diagnózu. V jedné studii byla anti-Gq1b IgG protilátka přítomna až u 95% pacientů s tímto onemocněním a chyběla u kontrol.3
neurologem diagnostikována, pacient s MFS na základě klinických trojice oftalmoplegie, ataxie a hyporeflexie, neprůkazný výsledek MRI a MRA mozku a zvýšené mozkomíšního moku bílkovin. Proto nebylo v tomto případě provedeno testování anti-Gq1b IgG protilátek.
Několik klinických funkcí MFS jsou také vidět v Guillain-Barré syndrom a Bickerstaff mozkového kmene, encefalitidu, takže diagnóza náročné. Pacienti pouze s Guillain-Barré mají slabost končetin, smyslovou ztrátu, lebeční neuropatii a areflexii bez oftalmologických projevů. Pacienti s Bickerstaff mozkového kmene, encefalitidu obvykle přítomné s oftalmoplegie, ataxie, hyper-reflexia a narušené vědomí. Od několika symptomy a příznaky jsou přítomny ve všech třech podmínkách, anti-GQ1b IgG titr protilátek testování je užitečné pro definitivní diagnózu. Anti-GQ1b IgG protilátky pozitivní ve velké většině Miller Fisher syndrom u pacientů v porovnání s 66% v Bickerstaff mozkového kmene, encefalitidu a 26% Guillain-Barré pacientů.16
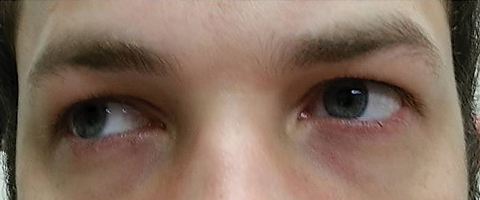
Obr. 3. Extraokulární motility odhalily omezení dextroverze. Klikněte na obrázek pro zvětšení.
léčba a následné sledování
pacient byl hodnocen den po přijetí, když uvedl, že nezaznamenal žádné vizuální změny ani zlepšení rovnováhy. Binokulární diplopie byla stále konstantní; proto pravé oko zůstalo opravené. Bolest očí s dalekými pohledy a rychlými pohyby očí byla stále přítomna. Při omezeném vyšetření u lůžka zůstaly nejlépe korigované zrakové ostrosti 20/20 v pravém a levém oku. Žáci byli rozšířeni v 8.0mm v obou očích s minimální reaktivitou, která se oproti předchozímu dni mírně zlepšila. Barevné vidění bylo normální v pravém a levém oku. Extraokulární motility byly plné ve všech kvadrantech s bolestí stále přítomnou na vzdálených horizontálních pohledech. Horizontální pronásledování zůstalo sakcadické s trhavými pohyby a koncovým nystagmem. Optické nervy vypadaly zdravě se zřetelnými okraji a poměrem šálku k disku 0, 15 v obou očích.
dva dny poté pacient uvedl zlepšení všech příznaků a že jeho oči “ se dnes cítí lépe než za nějakou dobu.“Bolest očí a binokulární diplopie byly vyřešeny. Zrakové ostrosti zůstaly 20/20 v pravém a levém oku. Velikost zornic byla 7,5 mm ve tmě a 7,0 mm Ve světle se zlepšenou přímou a konsensuální odpovědí v obou očích. Extraokulární pohyby byly plné ve všech kvadrantech bez bolesti očí. Horizontální pronásledování zůstalo sakcadické s trhavými pohyby a koncovým nystagmem. Neurologické vyšetření odhalilo abnormální reflexy, které zůstaly stabilní. Možnosti léčby MFS zahrnují plazmaferézu a intravenózní (IV) imunoglobulin IgG, ale tyto byly vzhledem ke zlepšení oftalmoplegie a ataxie odepřeny.
o čtyři dny později pacient hlásil, že se všechny příznaky stále zlepšují, s určitými obtížemi zaostřování a sledování při používání počítače. Rovnováha byla 80% vyřešena a došlo k několika výskytům distanční diplopie. Acuities zůstal 20/20 OU. Žáci byli 5,5 mm ve tmě a 4,0 mm Ve světle s 3 + přímými a konsensuálními odpověďmi OU. Extraokulární pohyby byly plné ve všech kvadrantech bez bolesti očí. Horizontální pronásledování bylo vylepšeno, bez sakádických pohybů. Monokulární ubytování bylo normální, což bylo měřeno 8,5 a 9 hranolových dioptrií OD A OS.
o týden později pacient oznámil, že se jeho vidění vrátilo téměř k normálu bez diplopie a mírných obtíží se zaměřením a sledováním. Zůstatek byl 100% vyřešen. Zrakové ostrosti zůstaly 20/20 v pravém a levém oku. Velikost žáků byla 5,5 mm ve tmě, 4,0 mm Ve světle s 4 + přímými a konsensuálními odpověďmi OU. Extraokulární pohyby byly plné ve všech kvadrantech bez bolesti očí. Horizontální pronásledování se zlepšilo bez pozorovaných sakadických pohybů. Oční zdraví bylo všední OU.
léčba byla přerušena vzhledem k ústupu oftalmoplegie a ataxie se stabilní areflexií. Úplné zotavení opthalmoplegie a ataxie trvalo dva týdny. Vedení zahrnovalo pečlivé sledování a sledování během čtyř týdnů; pacientovi bylo doporučeno vrátit se dříve, pokud se některý z jeho příznaků vrátí.
Klinické Funkce
V dobře popsaných studií MFS, všichni pacienti prezentovány s klinického trojice oftalmoplegie, ataxie a hyporeflexie.4,5 Nástup příznaků obvykle dochází během několika dnů, a pacienti trpí virovou infekcí jeden až čtyři týdny před nástupem klinických příznaků.4,5 podle jedné studie s 50 pacienty se stavem je průměrný interval mezi nástupem infekce a vývojem neurologických příznaků osm dní.4 Další znaky MFS patří nezřetelná řeč, potíže s polykáním a abnormální výraz obličeje s nemožností úsměv, nebo pískat.
oftalmologické rysy. Praktičtí lékaři by měli být na pozoru pro mydriázu, víko zatažení, akutní úhel uzavření a diplopie sekundární nervové ochrnutí postihující CN III, IV a VI.3,8,10,22,24 Diplopie je nejčastějším očním příznakem hlášeny v mnoha MFS studií.8,16,25,26,27 Diplopie je také počáteční příznakem hlášeny v 38,6% 223 pacientů v jedné odborné studie a 65% 466 pacientů ve druhé studii.8,27 ve druhé studii vykazovalo 100% pacientů vnější oftalmoplegii, zatímco vnitřní oftalmoplegie byla přítomna u 35% pacientů.27 vnější oftalmoplegie se týká poškození vnějších extraokulárních svalů. Vnitřní oftalmoplegie se týká poškození pupilárního svěrače a ciliárního svalu. Kompletní oftalmoplegie postihuje vnější i vnitřní svaly.
V retrospektivní studii 19 pacientů s MFS, všechny prezentovány s jedním nebo více nervů ochrnutí postihující okohybné svaly.25 další studie ukazují, že pacienti s MFS mohou mít mnohočetné obrny lebečních nervů, které se mohou projevit bilaterálně.22,24,25 jedním z běžných nálezů nalezených mezi Anti-gq1b IgG pozitivními poruchami je abdukční deficit v souladu s jednostrannou nebo bilaterální obrnou CN VI.26,28 Vnitřní oftalmoplegie způsobuje, zornice mydriáza, kde zúžení zornice na světlo a/nebo v blízkosti stimulace se může pohybovat od minimální až chybí.8,26 v jedné zprávě byla mydriáza přítomna u 42% pacientů. K postižení CN VII došlo přibližně u 45,7% pacientů s MFS, což způsobilo slabost obličeje, neschopnost usmívat se nebo pískat.8
ataxie. Příčina tohoto klinického rysu u MFS není zcela pochopena. Debata existuje o tom, zda je ataxie způsobena dysfunkcí centrálně v mozečku nebo periferně. První hypotéza, kterou navrhl Dr. Fisher, předpokládala zapojení Ia-aferentních neuronů.2 Toto bylo podpořeno druhou studií o desetiletí později, která ukázala abnormality Ia-aferentních vláken v MFS.11 Abnormální periferní nervy má také navrženo s nesoulad mezi propriocepční podněty z svalová vřeténka a kinestetické informace ze společného receptory.12
existují také podpůrné důkazy, že ataxie pochází z mozečku. Převahou anti-GQ1b IgG protilátky v mozečku byl nalezen pomocí imunocytochemické barvení lidského mozečku a dále potvrzeny western blot studií, které prokázaly zvýšenou anti-GQ1b IgG protilátky v MFS pacientů ve srovnání s kontrolou, i když mechanismus pro zapojení mozečku nebyl studován.13,14 v roce 2015 vědci zveřejnili kazuistiku pacienta s MFS, který podstoupil MRI. Byl snížen poměr n-acetylaspartát / kreatin, což naznačuje cerebelární dysfunkci, která se vrátila k normálu 2, 5 měsíce po zotavení.23
areflexie. Tento klinický rys, spolu s depresí hlubokých šlachových reflexů, je známkou zapojení periferního nervového systému do MFS. Elektrofyziologické studie potvrdily abnormální vedení periferních nervů v GBS a MFS.3 v jedné studii bylo 81,6% případů MFS vystaveno arefexii.8 další orientační studie ukázala, že všichni pacienti měli areflexii, která byla stále přítomna šest měsíců po nástupu.4
jak časté je MFS?
epidemiologické údaje o Millerově Fisherově syndromu jsou omezené. Výskyt MFS je poměrně vzácný a vyskytuje se u 0,09 na 100 000 lidí ročně.3 MFS se vyskytuje častěji u pacientů se syndromem Guillain-Barré, od 3% do 25%.4,6,7 tato asociace se vyskytuje více u pacientů z Dálného východu, což naznačuje možnou genetickou složku MFS. Průměrný věk nástupu je 43 let, s rozsahem 13 až 78,5 MFS postihuje muže dvakrát tolik než ženy s poměrem dvou až 1,03,5 MFS se vyskytuje více v zimním a jarním období.5,6,8 přesnou příčinu sezónní záliba nebyla stanovena, ale je pravděpodobné, související s post-infekční povahy onemocnění, jako bakteriální a virové infekce byly nalezeny, aby vyvolat autoimunitní reakci způsobuje produkci anti-GQ1b IgG protilátky v MFS.
Patofyziologie
patofyziologie Miller Fisher syndrom není dobře známa; nicméně, několik hypotéz existují z imunologické a histologické studie. Je dobře známo, že stav leží ve spektru anti-GQ1b IgG protilátky syndromy spolu s Guillain-Barré syndrom a Bickerstaff mozkového kmene, encefalitidu.
gangliosid GQ1b je skupina komplexních lipidů zapojených do centrálního a periferního nervového systému. GQ1b je součástí plazmatické membrány struktury v kraniální nervy, které zásobují okohybné svaly a podílí se na buněčné funkce na presynaptické nervosvalové ploténce.
autoimunitní mechanismus z předchozí spouštěcí infekce vytvoří anti – Gq1b IgG protilátku, která poškozuje funkci gangliosidu GQ1b a způsobuje demyelinizaci. Histologické studie prokázaly demyelinizaci a axonální otok v periferních a okulomotorických hlavových nervech.15 anti-gq1bigg protilátka chybí u zdravých pacientů, ale pozitivní u více než 90% pacientů s MFS.Bylo zjištěno, že 16,25
bakteriální a virové infekce vyvolávají autoimunitní odpověď, což způsobuje produkci anti-GQ 1b IgG protilátky. Následující infekční látky, které byly spojeny s MFS, zahrnují mykoplazmatickou pneumonii, HIV, Campylobacter jejuni, Hemophilus influenza, Helicobacter pylori a virus Epstein-Barr.4,16 v jedné zprávě, která se zabývala 466 pacienty s MFS, mělo 90% předchozí onemocnění, včetně infekce horních cest dýchacích,průjem nebo obojí.27
prognóza a léčba
Miller Fisherův syndrom je samo-omezující onemocnění a má celkově pozitivní prognózu. Příznaky se obvykle zlepšují po několika týdnech s úplným zotavením, které se obvykle vyskytuje za dva až tři měsíce. V jedné studii začalo zotavení v mediánu 13 dnů od nástupu příznaků a úplné vymizení oftalmoplegie a ataxie nastalo za šest měsíců.Bylo zjištěno, že 4,5 relapsů se vyskytlo v méně než 3% případů.4,5
ačkoli MFS je obvykle samo-omezující, systémové komplikace byly spojeny se stavem. Infekce horních cest dýchacích byly nalezeny v 56% 76% MFS pacientů, který se může vyvinout respirační selhání vyžadující mechanickou ventilaci.4,18,19 Mezi další vzácné závažné komplikace patří kardiomyopatie, laktátová acidóza a kóma.3,20
možnosti léčby MFS zahrnují plazmaferézu, IV imunoglobulin IgG a monitorování bez léčby. Vědci předpokládají, že plazmaferéza a IV IgG může být efektivní rychlost rozlišení doba od protilátek Gq1b IgG ve třídě a poločas IgG je přibližně 21 dní, což je déle než pět až šest den napůl-život IgM a IgA.19 nebyly však provedeny žádné randomizované dvojitě zaslepené placebem kontrolované studie zkoumající tyto léčby.
Jedna retrospektivní studie neprokázala plazmaferéza změnil šanci na úplné uzdravení a čas na vyřešení ataxie a oftalmoplegie; dále, interval od nástupu k zahájení plazmaferéza léčba neměla vliv na čas k řešení krize nebo závažnosti symptomů na začátku. Jedna kazuistika však naznačuje, že plazmaferéza je indikována, když je přítomna hluboká ataxie, motorické a respirační poškození.21
pacienti by měli být pečlivě sledováni z hlediska rizika vzniku závažných systémových komplikací, jako je selhání horních cest dýchacích. Studie neprokázaly žádné významné zlepšení doby zotavení S IV IgG nebo plazmaferézou léčba v MFS, takže monitorování může být nejlepší volbou lékaře.
i když je vzácný, stav nemusí být diagnostikován. Rozpoznáním klíčových klinických rysů mohou praktici odhalit příčinu symptomů svého pacienta a získat důvěru v úplné uzdravení.
Dr. Wang a Cantrell jsou zaměstnanci optometristů v Orlando VA Medical Center. Dr. Cali je personální optometrista na klinice Lee County VA. Autoři chtějí poděkovat Josephu Millerovi, od, Paul Gruosso, OD, A Vanessa Santos, OD, za pomoc s tímto rukopisem.
1. Collier J. periferní neuritida: přednášky Morisa. Edinburgh Med J. 1932: 39: 601-18.
2. Fisher m. neobvyklá varianta akutní idiopatické polyneuritidy (syndrom oftalmoplegie, ataxie a areflexie). N Eng J Med. 1956:255:57-65.
3. Lo YL a kol. Klinické a imunologické spektrum Millerova Fisherova syndromu. Svalový Nerv. 2007:36(5):615-27.
4. Mori M, Kuwabara S, Fukutake T, et al. Klinické rysy a prognóza Millerova Fisherova syndromu. Neurologie. 2001:56(8): 1105-6.
5. Mori M, Kuwabara S, Fukutake T, et al. Plazmafaréza a Miller Fisherův syndrom: analýza 50 po sobě jdoucích případů. Neurochirurg J. 2002:72:680.
6. Yuan CL, Wang YJ, Tsai CP. Miller Fisherův syndrom: retrospektivní studie založená na nemocnici. Euro J Neurol. 2000:44(2):79-85.
7. Cheng BC, Chang WN, Chang CS et al. Guillain-Barré syndrom na jižním Tchaj-wanu: klinické rysy, prognostické faktory a terapeutické výsledky. Euro J Neurol. 2003:10 (6):655-62.
8. Berlit P, Rakicky J. Miller Fisherův syndrom. Přehled literatury. J klinická neuro-oftalmologie. 1992:12:57-63.
9. Lyu RK, Tang LM, Cheng SY, et al. Guillain-Barré syndrom na Tchaj-wanu: klinická studie 167 pacientů. Neurochirurg J. 1997:63:494-500.
10. Tatsomoto M, Odaka M, Hirata K, Yuki N. Izolované obrna abducens jako regionální varianta Syndromu Guillain-Barré. J. 2006:243:35-8.
11. Weiss JA, bílý JC. Korelace aferentního vedení 1a s ataxií Fisherova syndromu. Svalový Nerv. 1986:9:327-32.
12. Das P, Biswash S, et al. Miller Fisher varianta syndromu guillain-barré: kazuistika a klinický přehled. Bangabandhu Sheikh Mujib Medical Univer J. 2012:5 (1): 69-71
13. Kornberg AJ, Pestronk A, Blume GM a kol. Selektivní barvení cerebelární molekulární vrstvy sérovým IgG Millera Fishera a příbuznými syndromy. Neurologie. 1996:47:1317-20.
14. Inoue N, Koh C, Iwahashi T. detekce sérových anticerebelárních protilátek u pacientů s Millerovým Fisherovým syndromem. Euro J Neurol. 1999:42:230-4.
15. Barontini F, Di Lollo S, Maurri S, Lambruschini P. Lokalizace patologického procesu v Miller Fisher Syndrom. Itálie J Neurol Sci. 1992:13:221-5.
16. Koga M, Yuki N, Takahashi M, et al. Blízko sdružení IgA anti-ganglioside protilátky s antecedent Campylobacter jejuni infekce u syndromu Guillain-Barré a Fisher je syndromy. J. 2003:141:112-7.
17. Guiloff RJ. Periferní nervové vedení u Millerova Fisherova syndromu. J. Neurol Neurochirurg Psychiatr. 1977:40:801-7.
18. Chikakiya H, Kunishige M, Yoshino H, et al. Zpožděná motorická a senzorická neuropatie u pacienta s mozkovou encefalitidou. J. 2005:234:105-8.
19. Arakata Y, Yoshimuro M, Kobayashi S, et al. Použití intravenózního imunoglobulinu u Millerova Fisherova syndromu. Vývoj Mozku J. 1993: 15:231-3.
20. Matsumoto H, Kobayashi O, Tamura K, et al. Miller Fisherův syndrom s přechodným kómatem: srovnání s bickerstaffovou mozkovou encefalitidou. Vývoj Mozku J. 2002: 24: 98-101.
21. Yeh JH, Chen WH, Chen JR, et al. Miller Fisherův syndrom s centrálním postižením: úspěšná léčba plazmaferézou. Therap Aferéza Dialýza J. 1999: 3: 69-71.
22. Papanikolaou T, Cath G, Boothman B, et al. Kazuistika: akutní bilaterální oftalmoparéza s pupilary areflexical mydriasis u Miller-Fisherova syndromu léčeného intravenózním imunoglobulinem. J. 2010; ID článku 291840.
23. Sandler RD, Hoggard N, Hadjivassiliou m. Miller-Fisherův syndrom: je ataxie centrální nebo periferní? Cerebellum Ataxias. 2015:2:3.
24. Ejma M, Waliszewska-Prosół M, Hofman A, et al. Progresivní subakutní Miller-Fisherův syndrom úspěšně léčen plazmaferézou. Polský Neurochirurg J. 2015;49(2):137-8.
25. San-Juan OD, Martínez-Herrera JF, Moreno García J, et al. Miller Fisherův syndrom: 10 let zkušeností v centru třetí úrovně. Euro Neurol. 2009; 62: 149-54
26. Snyder LA, Rismondo V, Miller nr. Fisherova varianta syndromu Guillain-Barré (Fisherův syndrom). J Neurooftalmol. 2009 Prosinec; 29 (4): 312-24.
27. Ito M, Kuwabara S, Odaka M, et al. Bickerstaff ‚ s brainstem encefalitida a Fisherův syndrom tvoří kontinuální spektrum: klinická analýza 581 případů. J. Neurol. 2008;255:674-82.
28. Yuki N. akutní paréza extraokulárních svalů spojená s IgG anti – gq1b protilátkou. Ann Neurol 1996; 39: 668-72.