Posts Tagged „teorie MO; cycloaddition; organická chemie; HOMO; LUMO; konjugovaný systém“
Jeden z nejnáročnějších pojmy v konjugovaný systém reakce je molekulární orbitální interakce, nebo MO teorie. Základy tohoto principu může být těžké pochopit, ale bude velmi informativní v predikci správné reakční podmínky a výsledky reakce, pokud jim rozumíte, což vám velkou výhodu na budoucí kvízy a zkoušky. My ve StudyOrgo jsme vymysleli jednoduché vysvětlení základů teorie MO, které vám pomohou s přípravami na studium.
principy teorie MO
základní koncept teorie MO je popsat střídavé vzory orbitalů, které existují v systémech vazeb pi. Popisujeme orientaci každé poloviny oběžné dráhy činky soustředěné kolem atomu jako odvážné nebo otevřené. Pamatujte, že existují vazby a antibonding orbitaly. V podstatě se orbitaly s nižším počtem uzlů (přepínače v orientaci orbitalu činky, které ukazujeme přerušovanou čarou) chovají spíše jako vazebné orbitaly, zatímco orbitaly s vyšším počtem uzlů se chovají jako anti-vazebné orbitaly. Chcete-li zjistit, jaké orbitaly jsou obsazeny ve vaší molekule, jednoduše spočítejte, kolik vazeb pi máte ve svém konjugovaném systému. Níže je uveden příklad butadienu. Má 4 pi elektrony, takže nejprve vyplníme nejnižší molekulární orbitaly, dva v každém orbitalu. Proto je nejvyšší obsazený molekulární orbital nebo HOMO v butadienu #2. Výsledkem je, že nejnižší neobsazený molekulární obital nebo LUMO v butadienu je #3. Můžeme to rozšířit na ethylen a uvidíme, že s 2 pi elektrony je molekulární orbital #1 HOMO a molekulární orbital #2 je LUMO.
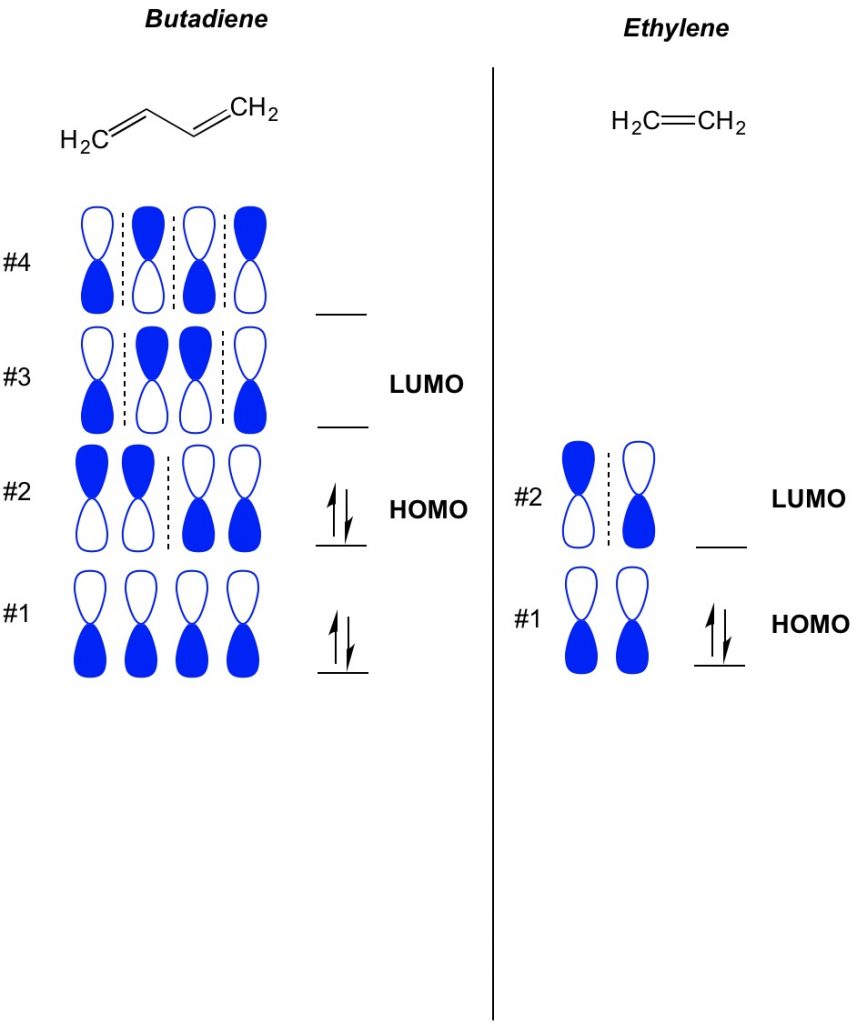
Cycloadditions MO Teorie
Pamatujte si, že cycloaddition reakce popsat tvorbu nových C-C sigma dluhopisů prostřednictvím přeskupení pi elektrony v konjugované systému. Proto musíme použít molekulární orbitaly pi elektronů k řízení reakce. Vezměme si reakci butadienu s ethylenem, což je nejjednodušší Dielova Olšová reakce (cykloadice 4+2). Začneme s nejvíce konjugovanou molekulou, butadienem a zkoumáme jeho HOMO. Pak se podíváme na nejméně konjugovanou molekulu, ethylen a zkoumáme jeho LUMO. Proč? Potřebujeme, aby elektrony z HOMO proudily z jedné molekuly do druhé, takže musíme použít LUMO orbital, který není pro tento proces obsazen. Vidíme, že uzly HOMO a LUMO zarovnat; to je otevřené a uzavřené poloviny činek zarovnat. To vede k dopředné reakci a tvorbě produktu, cyklohexenu.
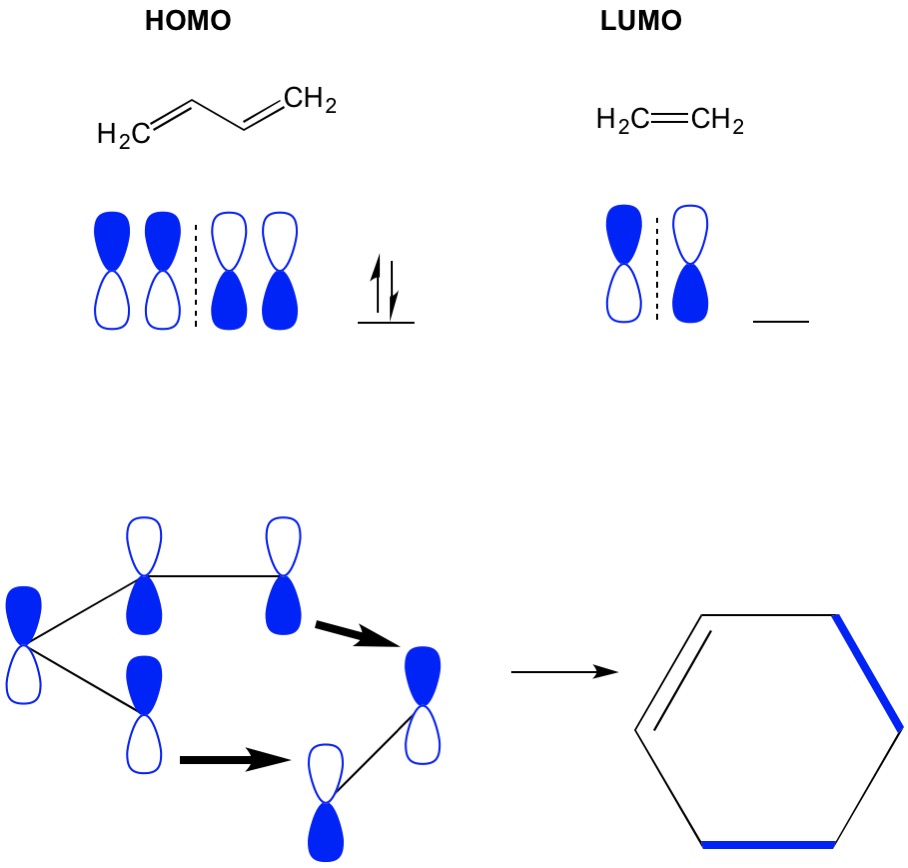
Nicméně, další příklad, kde máme (2+2 cycloaddition), vidíme, že HOMO a LUMO ethylenu není sladit tak odpudivou reakci. Máme však schopnost vzrušovat elektrony z HOMO na vyšší orbital pomocí světla (hv) nebo tepla, čímž se mění HOMO. Tento koncept podrobně přezkoumáváme v předchozím článku. Když to uděláme, HOMO excitovaného ethylenu a LUMO ethylenu v přízemí se zarovná a reakce vytvoří cyklobutan.
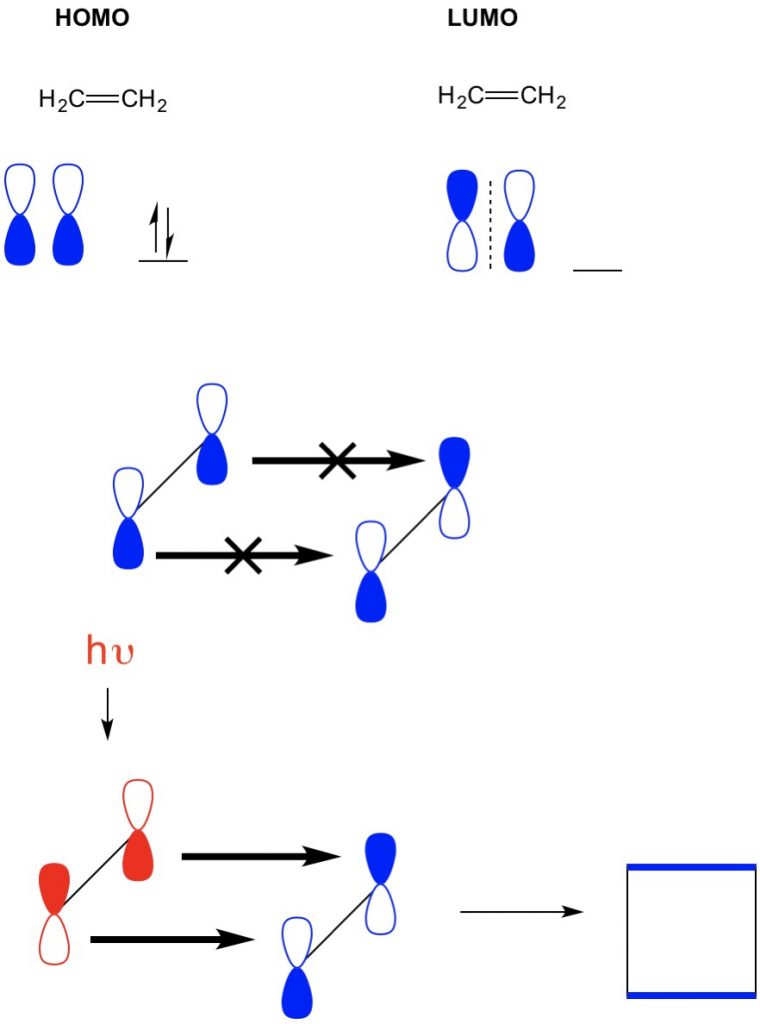
doufáme, že tento popis pomohl objasnit tyto pojmy teorie MO. Toto je příklad jasných a jednoduchých expatiací, které jsme připravili pro více než 175 reakcí běžně pozorovaných v kurzech Orgo1 a Orgo2. Zaregistrujte se ještě dnes pro potřeby přípravy na studium!