Malé Střevní Kartáč Hranice Enzymy
VIVO Patofyziologie
Malé Střevní Kartáč Hranice Enzymy
posledním krokem při trávení potravinových sacharidů a proteinů se vyskytuje na obličeji malých střevních enterocytů, v bezprostřední blízkosti transportéry, které budou trajekt výsledný cukrů a aminokyselin do buněk epitelu. Enzymy odpovědné za tento terminál fázi trávení nejsou volné v lumen střeva, ale spíše upoutaná jako integrální membránové proteiny v plazmatické membráně enterocytů. Apikální plazmatické membrány bydlení těchto enzymů je složena z četné mikroklky, které sahají od buňky a představují „kartáč hranice“. Proto enzymy vložené do těchto mikrovilli jsou označovány jako kartáč hraniční enzymy.
hustota a distribuce kartáč hranice enzymů se liší mezi různými segmenty tenkého střeva a často se liší v závislosti na věku zvířete. Navíc, v některých případech je koncentrace těchto enzymů může být modulovaná dieta, například, množství sacharázy-izomaltázy enzymu se zvyšuje u zvířat krmených high-sacharidů stravy.
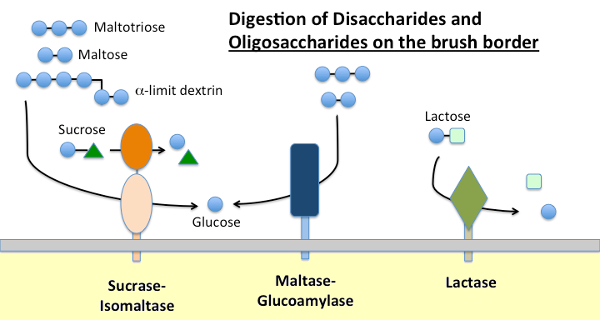
Maltáza-Glukoamyláza a Sacharázy-Izomaltázy
Dietní škrob je štěpen α-amylázy přítomné v pankreatické sekretu a v mnoha druhů, sliny. Amyláza hydrolyzuje vnitřní α-1,4 glykosidickými vazbami na škrob generovat maltóza, krátké oligosacharidy (např. maltotriose) a tzv. limitní dextriny, což jsou pobočky bodů v amylopektinu. Žádná z těchto molekul nemůže být absorbována přes epitel tenkého střeva a vyžaduje další hydrolýzu, nakonec na glukózu.
Maltáza-glukoamyláza a sacharázy-izomaltázy jsou úzce příbuzné enzymy vložené v křoví hraniční membrána, která spusťte terminál fáze trávení s použitím podkladů poskytnutých amyláza:
- Maltáza-glycoamylase má dvě aktivní místa. Místo maltázy hydrolyzuje terminální α-1,4-vázané d-glukózové zbytky z maltózy nebo maltotriózy a vytváří α-D-glukózu. Místo glukoamylázy má také aktivitu α-1,4 hydrolýzy, ale také hydrolyzuje α-1,6 glykosidické vazby, když jsou sousedící s vazbou α-1,4, uvolňující β-D-glukózu.
- Sacharáza-isomaltáza má také dvě aktivní místa s různými specifiky. Místo sacharázy katalyzuje hydrolýzu sacharázy na fruktózu a glukózu a je také schopno hydrolyzovat maltózu. Místo isomaltázy je důležité jako hlavní mechanismus pro trávení vazeb α-1,6 limitních dextrinů.
Laktázy
Laktázy, jak jeho název napovídá, je disaccharidase, který hydrolyzuje laktózu na galaktózu a glukózu; formálně, to je β-glukózy. Laktóza je hlavní sacharid v mléce a laktáza je hojně přítomna v tenkém střevním okraji mladých savců. U většiny druhů, včetně lidí, exprese laktázy klesá krátce po odstavení. U většiny lidí je tato perzistence aktivity laktázy v dospělosti spojena s“intolerancí laktózy“. Rozdíl mezi perzistencí laktázy a perzistencí je geneticky určen.
Peptidáz
Existuje velké množství štětcem hranice peptidáz, které společně mohou rozpouštějí rozmanité sekvence aminokyselin rozmanitosti přítomných v dietní proteiny. Mezi hlavní třídy peptidáz patří:
- Exopeptidázy, které hydrolyzují terminální aminokyseliny z peptidů. Některé z těchto enzymů mají aktivitu proti C-terminální zbytky a ostatní práce na N-koncových aminokyselin. Jejich aktivita poskytuje volné aminokyseliny nebo dipeptidy. Jako příklad enzymu, specifičnost a rozmanitost, aminopeptidázy P hydrolyzuje N-koncových aminokyselin z di-, tri – a oligopeptidy, ale pouze tehdy, pokud jsou spojeny s prolin, vzhledem k tomu, aminopeptidázy A katalyzuje hydrolýzu koncových kyselých aminokyselin, jako je glutamát a aspartát.
- Endopeptidázy štěpí peptidové řetězce interně a poskytují menší peptidy s různou délkou řetězce.
- jediná dipeptidáza existuje také jako brush border enzym.
Enteropeptidase, také známý jako enterokinázou, je další kartáč hranice enzym, který má důležitou aktivitou katalyzující activiation z trypsinogen na trypsin, jeden z hlavních proteázy ze slinivky břišní. Enteropeptidáza je nejčastěji přítomna v dvanáctníku.
lipázy
řada lipáz je přítomna v okraji štětce tenkého střeva. Patří sem fosfolipáza B1, neutrální ceramidáza a alkalická sfingomyelináza.