Design PRAŽCI-TaqMan sondy pro multiplex real-time PCR pomocí interní pozitivní kontrola
Úvod
Real-time PCR umožňuje nepřetržité monitorování fluorophore fluorescence během generace produktů PCR v uzavřené trubici formátu. V současné době, dostupné metody využívají buď značené sondy nebo DNA interkalatační barvivo pro sledování amplifikace produktu PCR. Na TaqMan sonda je single-stranded oligonukleotid obsahující fluorophore a hasič umístěny 10-30 základny od sebe. Na TaqMan sonda je hydrolyzovaný během amplifikace vzhledem k 5′-3′ double-strand–specifické exonuclease aktivity Taq polymerázy, která odděluje fluorophore od hasič, což vede k zvýšení fluorescence. Real-time PCR přístroje jsou vybaveny fluorescenční detektory a software schopný odhad cyklu prahové hodnoty (Ct), cyklus, ve kterém fluorescence je větší než pozadí fluorescence, pozitivní reakce. Tato technika však nemůže rozlišit skutečný negativní výsledek od falešně negativního, pokud je PCR ovlivněna inhibitory amplifikace. Po extrakce nukleové kyseliny, uvádí se, že inhibitory může být stále přítomen z klinických vzorků (např. hemoglobin), environmentální vzorky (např. huminových kyselin), a chemických látek použitých během extrakce nukleové kyseliny (např. ethanol, detergenty, nebo chaotropic agentů). Spolehlivost diagnostických testů se zvyšuje zahrnutím vnitřní kontrolní nukleové kyseliny, která může indikovat přítomnost a dopad inhibitorů PCR(1,2). Interní pozitivní kontrola (IPC) je zesílen současně v přítomnosti cílové sekvence pomocí značené fluorophore, které vyzařuje světlo na jiné vlnové délce, než fluorophore používá pro cílové sekvence testu, s dvěma fluorophores zjištěny v různých kanálů pomocí real-time PCR přístroje. Běžně používanou interní kontrolou pro PCR je plazmid, který obsahuje sekvenci podobnou sekvenci testovacího cíle s výjimkou oblasti sondy. Omezený počet molekul IPC je přidán k individuálnímu cíli testu a současně amplifikován s cílovou nukleovou kyselinou; pozitivní IPC signál je tedy důkazem, že amplifikační reakce probíhala dostatečně pro generování pozitivního signálu z velmi malých množství cílové nukleové kyseliny. Tato funkce je důležitá pro zajištění ekvivalentní amplifikace IPC a cílové nukleové kyseliny (3-9). Nicméně, některá zařízení—například LightCycler 1.2 a LightCycler 2 (Roche Applied Science, Indianapolis, IN, USA), Ruggedized Advanced Pathogen Identification Device (R. a. P. I. D.) přístroje (Idaho Technology, Salt Lake City, UT, USA) a ruční PCR přístroje v reálném čase-jsou vybaveny pouze jedním světelným zdrojem a přidruženým emisním kanálem. Multiplexování na těchto typech nástrojů vyžaduje použití více značených oligonukleotidů a konceptu přenosu fluorescenční rezonanční energie (FRET). Nicméně, FRET sondy mohou být náročné na konstrukci a mohou postrádat robustnost v hypervariovatelných oblastech a pokud jsou přítomny neoptimální podmínky zesílení. Použití PRAŽCOVÝCH sond vyžaduje identifikaci dvou oblastí pro dvě sondy. FRET sondy systém spoléhá na přilehlé hybridizace oligonukleotidů na dvě samostatné značené sondy tak, fluorescence akceptoru barvivo je detekován přes excitaci fluorophore připojen k druhé sondy. Hlavní nevýhodou pražcové sondy je požadavek větší oblasti sekvence potřebné pro uložení dvou sousedních sond s mezerou 2-5 nukleotidů. Existuje možnost multiplexování s jinými štítek systémů, jako MegaStokes barvivo (DYXL; Dyomics, Jena, Německo) a Pulsar 650 (Biosearch Technologies, Inc., Novato, CA, USA), ale tyto systémy označování vyžadují spektrální informace, aby kompenzovaly přeslechy kanálů a nejsou široce dostupné. Sonda FRET-TaqMan vyvinutá v této studii však nevyžaduje software pro kompenzaci barev a používá fluorofory (FAM, Cy5.5), které jsou široce dostupné. Tato zpráva se zaměřuje na konstrukci triple-značené sondy, umožňující multiplexování v nástroji vybaven pouze jedno modré světlo emitující dioda (LED) budící zdroj (470 nm) a s nimi spojené tři odpovídající detekce kanálů (např. 530 nm, 640 nm, a 705 nm).
Materiály a metody
Sonda princip konstrukce
Všechny experimenty byly provedeny na Idaho Technology. R. a. P. I. D. systém, 32-vzorek přenosný real-time PCR přístroj vybaven modrou LED pro excitaci (470 nm) a s nimi spojené tři fluorescenční detekcí programy, které měří fluorescence na 530, 640 a 705 nm pro mono-a dual-barevné testy. Primery JVAF a JVAR (10) a sondy 5′-FAM/BHQ-1 byl syntetizován v CDC Biotechnologie Core Facility (Atlanta, GA, USA) a sonda 5’FAM-Cy5.5/3’BHQ-3 byl syntetizován v Idaho Technology. Pro oboustranný TaqMan PCR, jedna sonda byla označena s 5′-FAM/BHQ-1 (520 nm fluorescenční vlnové délce) a další s 5’FAM-Cy5.5/3’BHQ-3 (705 nm fluorescenční vlnové délce). V roztoku sondy označené s 5’FAM-Cy5.5/3’BHQ-3 zůstává rozloží na hybridizaci, aby se pořadí, a na následné štěpení sondy enzymatickou primer extension, hasič je eliminován. To má za následek FRET prostřednictvím buzení FAM světelným zdrojem R. A. P. I. d. nástroje. Excitační energie se přenáší na akceptor fluoroforu, Cy5.5 a emitovaná fluorescence se měří ve druhém fluorescenčním kanálu (fluorescenční kanál F3 pro přístroj R. A. P. I.d.). Emise fluorescence Cy5. 5 je výsledkem kombinace technik sondy FRET a TaqMan, takže tyto trojitě značené sondy lze označit jako sondy“ FRET-TaqMan“.
Primery, sondy a plasmidu
prokázat multiplexování schopnosti STARAT-TaqMan design, jsme použili rod-specifické Cryptosporidium real-time PCR k amplifikaci 159-bp část 18S rRNA genu (10). Forward primer (JVAF) byl 5′-ATGACGGGTAACGGGGAAT-3′, reverzní primer (JVAR) byl 5′-CCAATTACAAAAC-CAAAAAGTCC-3′, a TaqMan sonda (JVAP) byl 5′-FAM-CGCGCCTGCT-GCCTTCCTTAGATG-BHQ1–3′, odpovídající nukleotidy, 100-118, 258-236, a 184-161, respektive, z GenBank přistoupení ne. AY458612. Primery pro konstrukci Cryptosporidium IPC obsahovaly stejnou sadu primerových sekvencí hlášených pro amplifikaci Cryptosporidium spp., s výjimkou oblasti vázající sondu cílové DNA, která byla nahrazena umělou sekvencí 5′ – TTGTGCTCGTAGTCGCCTCTCT-3′ (JPIPC). Tato sekvence sondy měla žíhací teplotu 69°C a byla navržena tak, aby neměla žádnou sekundární strukturu. Teoretická specificita pro vnitřní sondu byla zjištěna výbuchem (11) hledání sond a primerových sekvencí, ve kterých nebyla nalezena přesná shoda s žádnou Kryptosporidovou sekvencí. Fragment IPC byl syntetizován a klonován do plazmidu integrovanými technologiemi DNA (Coralville, IA, USA). Známá koncentrace plazmidové DNA (100 kopií / reakce) byla přidána do hlavní směsi všech reakcí s výjimkou negativní kontroly. Trojitě značená sonda (JPIPC) specifická pro IPC byla syntetizována technologií Idaho, jak je znázorněno na obrázku 1. FAM/Cy5.5/BHQ3 oligo-nukleotidové sondy byl syntetizován začíná na 3′ konec s non-fluorescenční Černé Díry Hasič (BHQ-3) řízené pórů skla (CPG). 5 ‚konec byl potom konjugován s fosporamiditem Cy5.5, následovaným fosporamiditem terminálního 5‘ fluoresceinu (6-FAM).
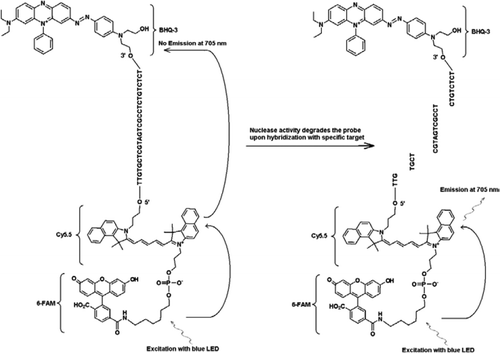
PRAŽEC-TaqMan sonda obsahuje tři štítky: černé díry hasič skupinu na konci 3′ rameno, vysílač fluorophore (Cy5.5), a kombajn fluorophore (FAM) se spojily na konci jeho 5′ rameno. Fam účinně absorbuje energii z modré LED jako světelného zdroje. Při absenci cílů je sonda tmavá, protože energie absorbovaná FAM je přenesena na Cy5. 5 a energie uvolněná z Cy5.5 se přenáší do zhášeče a ztrácí se jako tepelná energie. V přítomnosti cíle, TaqMan sonda je štěpen aktivitu Taq polymerázy a hasič se uvolní a energie pohlcené FAM je převedena na Cy5.5 prostřednictvím FRET mechanismus emitovat fluorescenci při 705 nm.
Real-time PCR assay
Flow cytometrie řazeny oocyst Cryptosporidium parvum (200 oocyst per trubice) získané z University of Wisconsin je Stát, Laboratoř Hygieny (Madison, WI, USA). DNA od C. parvum oocysty byly extrahovány pomocí protokolu popsaného Hill et al. (12) a suspendován v 80 µL Tris EDTA (TE, pH 8,0) pufru. Na reakci byly přidány dva mikro-litry DNA, což odpovídalo 5 oocyst (což odpovídá 100 kopiím cílové DNA). Amplifikační reakční směs se skládala z kvantifastové sondy PCR + Rox Kit reakční směsi (Kat. no. 204354; Qiagen) bez přidání ROX, jvaf, JVAR primery (každý 0,4 µM), jvap sonda (0,2 µM), jpipc sonda (0,2 µM) a 100 kopií IPC. Do reakční kapiláry (Roche Diagnostics, Indianapolis, IN, USA) obsahující 18 µL reakční směsi byl přidán alikvot (2 µL) extrahovaného vzorku DNA. 2, plot 1), plazmid IPC (Obrázek 2, plot 2), směs pozitivní kontroly C. parvum a IPC (Obrázek 2, plot 3) a kontrola bez šablony (NTC) sestávající z vody bez nukleázy (Kat. č. AM9932; Ambion, Foster City, CA, USA) místo DNA (Obrázek 2, spiknutí 4) byly zahrnuty do každého experimentu. Protokol trval ∼30 minut, než byly splněny následující podmínky PCR: hot-start krok denaturace při 95°C po dobu 3 min, následovalo 45 cyklů 95°C denaturace 5 s, 60°C žíhání po dobu 30 s s jedním fluorescence akvizice (s teplotní rampou rychlost 20°C/s). Pozitivní výsledek byl zaznamenán pro FAM v kanálu F1 (530 nm) a pro Cy5.5 v kanálu F3 (705 nm). Amplifikační reakce byly prováděny ve trojím vyhotovení. Amplikony (159 bp) byly vizualizovány elektroforézou v agarózovém gelu a Glow-Zelená nukleové kyseliny barvení (eEnzyme, Gaithersburg, MD, USA) k potvrzení specificity PCR produktu.
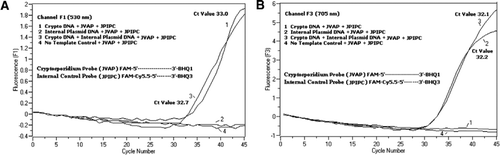
ve všech reakčních směsích PCR byla přidána ekvimolární směs Fam/BHQ1 a Fam/Cy5.5/BHQ3. (A) kanál F1 monitoruje zvýšení fluorescence FAM na přítomnost C. parvum. Plot 1 (kanál F1 primárně sbírá Fam signál) obsahující pouze C. parvum DNA odhalila Kryptosporidium-specifický Fam signál v PCR. Spiknutí 2 obsahovalo pouze plazmidovou DNA a žádný signál FAM ze sondy FAM / Cy5. 5 / BHQ3. Zápletka 3 obsahovala oba C. parvum a plasmid DNA, ale produkoval pouze C. parvum-specifický Fam signál. Plot 4 byl negativní vzorek obsahující pouze vodu bez nukleázy místo jakékoli templátové DNA; ze sond nebyla pozorována žádná fluorescence. (B) kanál F3 monitoruje zvýšení Cy5. 5 na přítomnost vnitřní kontrolní plazmidové DNA. Plot 1 obsahoval pouze DNA C. parvum a žádný fluorescenční signál ze sondy FAM/ BHQ1. Plot 2 (kanál F3 primárně shromažďuje Cy5.5) signál obsahující pouze plazmidové DNA odhalila vnitřní plasmidová kontrola (IPC)–specifické Cy5.5 signál v PCR. Zápletka 3 obsahovala oba C. parvum a plasmid DNA, ale produkoval pouze IPC specifický signál Cy5. 5. Plot 4 byl negativní vzorek obsahující pouze vodu bez nukleázy místo jakékoli templátové DNA; ze sond nebyla pozorována žádná fluorescence.
Výsledky a diskuse
Real-time PCR, fluorescenční signály odrážející zesílení C. parvum genomické DNA byla detekována v kanálu F1 (Obrázek 2A) vzhledem k FAM značení TaqMan sondy. Fluorescenční signál odrážející zesílení IPC byl detekován v kanálu F3 (obrázek 2B) kvůli FAM/Cy5.5 označení sondy IPC TaqMan. Tato sonda vyrobená zvýšení Cy5.5 v kanálu F3 (Cy5.5), ale žádné zvýšení FAM v kanálu F1 (FAM), když BHQ3 je oddělena od FAM/Cy5.5 vzhledem k nuclease činnost, protože energie byla převedena z FAM pro Cy5.5. Podobně v duplexní reakci byla v kanálu F1 detekována amplifikace genomové DNA C. parvum, zatímco amplifikace IPC byla současně detekována v kanálu F3. FAM má buzení při 495 nm a emise při 520 nm. Cy5. 5 má excitaci 690 nm a emisi 705 nm. S tak blízko takových památek, mezi Cy5.5 a FAM na triple s označením IPC sondy, Cy5.5 fluorophore emituje fluorescenční vzhledem k dokončení převodu energie z FAM fluorophore, což v žádném fluorescenční emise FAM v kanálu F1 (Obrázek 2A). Negativní kontrolní reakce neprokázaly zvýšení fluorescence v důsledku FAM nebo Cy5. 5. Tyto výsledky také ukazují, že jeden modrá (470 nm) LED, zdroj je dostatečný k monitorování duální fluorescenční emise přes F1 (530 nm) a F3 (705 nm) programy bez jakéhokoli spektrální překryv v příslušné monitorovací programy pro FAM a Cy5.5. Technika FRET-TaqMan byla také testována pomocí panelu 12 dna extraktů ze vzorků stolice (8 ze vzorků dříve stanovených jako pozitivní na Cryptosporidium spp. a čtyři vzorky, které byly negativní na Cryptosporidium spp.). 18S rRNA test byl schopen detekovat všech osm Cryptosporidium spp. Bylo zjištěno, že test IPC TaqMan amplifikuje pouze plazmidovou DNA IPC. IPC testu vedly v Ct hodnoty 32-37, které je uvedeno až 5 Ct hodnot PCR inhibice pro některé vzorky stolice (32 byl očekávaný Ct hodnota pro ne-inhibice reakce).
současná technika se liší od tradičně používaných ZDŮRAZNIT, že jeden fluorescenčně značené oligonukleotidových sond (FRET-TaqMan sonda) místo dvou sond (FRET sondy), ve kterém jedna sonda obsahuje dárce fluorophore a další sonda obsahuje akceptor fluorophore (13,14). PRAŽEC-TaqMan sondy značené na 5′ konci se dvěma fluorophores dárce (FAM) a akceptor (Cy5.5) fluorophores a na 3′ konci s BHQ-3 hasič jako TaqMan sondy. Unikátní sonda-závazné regionu je zvolen pro odlišení od cílové DNA, a sledovat tak dva různé fluorescenční měření ve dvou různých detekčních kanálů (530 nm v F1 a 705 nm v F3) ze stejné amplifikační reakce bez nutnosti zahrnout kompenzace barvy software. Cílová DNA a IPC měly stejná vazebná místa primeru, ale jinou sekvenci sondy. Tím je zajištěno, že použití stejných primerů pro oba cíle DNA k minimalizaci tvorby primeru-dimeru nebo interakce mezi sadami primerů. Když jsou fluorofory FAM / Cy5. 5 umístěny těsně na 5 ‚ konci, dochází k přenosu rezonanční energie se zvýšením fluorescenční emise fluoroforu Cy5.5. Nicméně, použití BHQ3, non-fluorescence akceptoru pro Cy5.5, snižuje potenciál pozadí fluorescence, což má za následek vyšší signál-šum. Bylo zjištěno, že přidání 100 kopií IPC k reakci obsahující ∼100 kopií genomického C. parvum DNA vedla k podobným hodnotám Ct (Ct = 32), když byl test Cryptosporidium TaqMan proveden jako test singleplex a jako duplexní test s testem IPC TaqMan. Při aplikaci na panelu Cryptosporidium pozitivní vzorky DNA, IPC uvedeno, že některé vzorky neobsahovaly PCR inhibitory (na základě očekávané hodnoty Ct 32), ale ostatní exempláře byly spojeny s inhibicí až 5 Ct hodnot.
nově vyvinutý vnitřní PCR pozitivní kontrola ukázala být citlivé a specifické pro simultánní detekci dva cíle ve stejné reakce vzhledem k označování s FAM/Cy5.5-BHQ3 a FAM/BHQ1 pro příslušné IPC a 18S rRNA cílového genu v dual-barva multiplex PCR pro monitorování v F1 a F3 fluorescenční kanály R. a. P. I. D nástroj. Použití 5’FAM-Cy5.5/3’BHQ-3–značené sondy jako druhý reportér je výhodné, protože emisní maxima obou sond byly dobře rozmístěny od sebe navzájem. PRAŽEC-TaqMan triple-značené sondy návrh by mohl mít aplikace v rozvojových levné, na jedno použití „lab-on-a-chip“ zařízení s optika se skládá z jedné modré LED excitace a dva zdroje emisí 530 nm a 705 nm, s vhodnými optickými filtry pro detekci FAM v jednom kanálu a Cy5.5 v druhé. Tato kombinace by nevyžadovala dva vysoce výkonné fluorescenční zdroje a detekční systémy.
Poděkování
autoři na vědomí, pomoc Mike Pravomoci na Sekvenování DNA a Genomické Core Facility (University of Utah, Salt Lake City, UT, USA) a Rachelle Muller na Idaho Technology, Inc. pro diskusi o vývoji vnitřní pozitivní kontroly pro R. a. P. I. D cyklovač. Tato publikace byla částečně podpořena prostředky poskytnutými prostřednictvím Centra pro kontrolu a prevenci nemocí, koordinační úřad pro připravenost na terorismus a reakci na mimořádné události. Použití obchodních názvů a obchodních zdrojů slouží pouze k identifikaci a neznamená schválení centrem pro kontrolu a prevenci nemocí nebo americkým ministerstvem zdravotnictví a sociálních služeb.
- 1. Hartman, L. J., S. R. Coyne a D. a. Norwood. 2005. Vývoj nové interní pozitivní kontroly pro testy založené na Taqmanovi. Molo. Buňka. Sondy 19: 51-59.Crossref, Medline, CAS, Google Scholar
- 2. Hoorfar, J., B. Malorny, a. Abdulmawjood, n. Cook, m. Wagner a P. Fach. 2004. Praktické úvahy při návrhu Interních amplifikačních kontrol pro diagnostické PCR testy. J. Clin. Mikrobiol. 42:1863–1868.Crossref, Medline, CAS, Google Scholar
- 3. Betsou, F., K. Beaumont, J. M. Sueur a J. Orfila. 2003. Konstrukce a vyhodnocení vnitřní kontrolní DNA pro PCR amplifikaci Chlamydia trachomatis DNA ze vzorků moči. J. Clin. Mikrobiol. 41:1274–1276.Crossref, Medline, CAS, Google Scholar
- 4. Burggraf, S. A B. Olgemoller. 2004. Jednoduchá technika pro vnitřní kontrolu amplifikačních testů v reálném čase. Cline. Cheme. 50:819–825.Crossref, Medline, CAS, Google Scholar
- 5. Drosten, C., M. Weber, e. Seifried a W. k. Roth. 2000. Vyhodnocení nového PCR testu s konkurenční interní kontrolní sekvencí pro screening dárců krve. Transfúze 40: 718-724.Crossref, Medline, CAS, Google Scholar
- 6. Gruber, F., F. G. Falkner, F. Dorner a T. Hammerle. 2001. Kvantifikace virové DNA pomocí PCR v reálném čase pomocí duplexní amplifikace, vnitřní standardizace, a dvoubarevná fluorescenční detekce. Appl. Environ. Mikrobiol. 67:2837–2839.Crossref, Medline, CAS, Google Scholar
- 7. Rosenstraus, M., Z. Wang, S.Y. Chang, D. DeBonville a J. P. Spadoro. 1998. Interní kontrola rutinní diagnostické PCR: design, Vlastnosti a vliv na klinický výkon. J. Clin. Mikrobiol. 36:191–197.Medline, CAS, Google Scholar
- 8. Stocher, m., v. Leb a J. Berg. 2003. Pohodlný přístup ke generování vícenásobné vnitřní kontrolní DNA pro panel PCR testů v reálném čase. J. Virol. Metody 108: 1-8.Crossref, Medline, CAS, Google Scholar
- 9. Zimmermann, K. A J. W. Mannhalterovi. 1996. Technické aspekty kvantitativní konkurenční PCR. BioTechniques 21: 268-279.Odkaz, CAS, Google Scholar
- 10. Jothikumar, N., A. J. da Silva, i. Moura, y. Qvarnstrom a v. r. Hill. 2008. Detekce a diferenciace Cryptosporidium hominis a Cryptosporidium parvum pomocí duálních Taqmanových testů. J.Med. Mikrobiol. 57:1099–1105.Crossref, Medline, CAS, Google Scholar
- 11. Altschul, s.F., W. Gish, W. Miller, E. W. Myers a D. J. Lipman. 1990. Základní místní zarovnání vyhledávací nástroj. J. Mol. Biol. 215:403–410.Crossref, Medline, CAS, Google Scholar
- 12. Hill, V. R., A. M. Kahler, N. Jothikumar, T. B. Johnson, D. Hahn, a. T. L. Cromeans. 2007. Vícestupňové hodnocení postupu založeného na ultrafiltraci pro současné zotavení enterických mikrobů ve vzorcích 100-litrové vody z vodovodu. Appl. Environ. Mikrobiol. 73:4218–4225.Crossref, Medline, CAS, Google Scholar
- 13. Bernard, P. S., M. J. Lay a C. T. Wittwer. 1998. Integrovaná amplifikace a detekce bodové mutace C677T v genu methylenetetrahydrofolátreduktázy pomocí fluorescenčního rezonančního přenosu energie a křivek tání sondy. Anální. Biochem. 255:101–107.Crossref, Medline, CAS, Google Scholar
- 14. Wittwer, C. T., M. G. Herrmann, a. a. Moss, a. R. P. Rasmussen. 1997. Continuous fluorescence monitoring of rapid cycle DNA amplification. BioTechniques 22:130–138.Link, CAS, Google Scholar