Basicity Aminů A pKaH
Kvantifikaci Basicity Aminů, Pomocí „pKa Konjugovaných Kyselin“.k.a. „pKaH“
Jak se měří basicity z amine? Příklad: co je silnější báze: pyridin nebo piperidin?
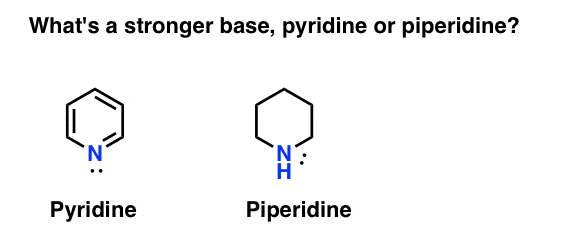
Pokud jste řekl, že piperidine, gratulujeme – to je opravdu silnější základnu.
ale proč? A o kolik silnější? Jak se člověk snaží odpovědět na tyto otázky? Koneckonců, můžeme snadno porovnat sílu kyselin zkoumáním jejich pKa. neměli bychom být schopni udělat totéž s bázemi?
Ano, svým způsobem. Zde jsou dva klíčové body pro dnešek:
- nejlepší způsob, jak kvantifikovat zásaditost Aminu, je zkoumat pKa jeho konjugované kyseliny.
- čím vyšší je pKa konjugované kyseliny, tím silnější je báze.
v tomto příspěvku ukážeme některé konkrétní příklady, jak použít hodnoty pKa k porovnání zásaditosti aminů.
v následujícím příspěvku pak prozkoumáme některé klíčové trendy, které jsou základem zásaditosti aminů.
Obsah
- Rychlý přehled: Kyseliny, zásady, Konjugované Kyseliny, a Konjugovaná Báze
- Pomocí pKa Pro Měření Kyselosti
- Pomocí pKa Kvantifikovat Basicity Aminů
- „pKa Konjugovaná Kyselina“ Může Být Zkráceně Jako „pKaH“
- Pomocí pKaH K Určení Relativní Basicities Aminů
- několik Slov, Upozornění Na Hodnoty pKa Pro Aminy
- Jaké hlavní Faktory Se Řídí Basicity Aminů?
- poznámky
1. Rychlá Recenze: Kyseliny, zásady, konjugované kyseliny a konjugované báze
nejprve si rychle prohlédneme některé základy zásaditosti.
v každé acidobazické reakci jsou čtyři aktéři.
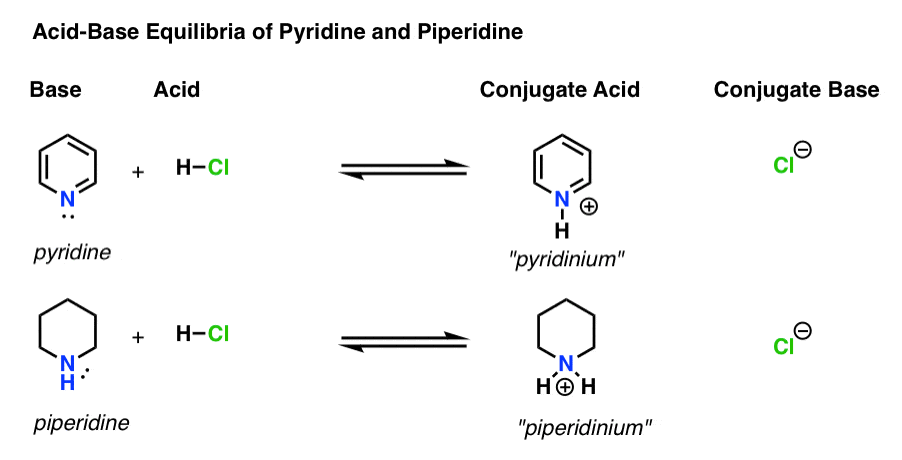
- báze je druh, který daruje osamělý pár H+ (také známý jako „proton“ nebo „vodíkové jádro“). To je místo, kde nový bond H forem (např. pyridin, níže)
- konjugovaná kyselina je druh, který výsledky po základní formy pouto k H (např. „mezi pyridiniové“ , která má novou N–H vazba)
- kyseliny jsou druhy, které ztrácí H+ . Je to místo, kde se vazba na H zlomí (např. H-Cl)
- konjugovaná báze je druh, který zůstává poté, co kyselina daruje H + báze (např. Cl -)
zde je pyridin a piperidin v akci. Sledováním vazeb, které se tvoří a lámou, můžete identifikovat každého herce.
2. Použití pKa k měření kyselosti
každá acidobazická reakce může být zapsána jako rovnováha mezi dopřednou a reverzní reakcí. Viděli jsme, že konstanta kyselosti, Ka, je měřítkem toho, jak snadno se druh disociuje, aby dal H+ a konjugovanou bázi.
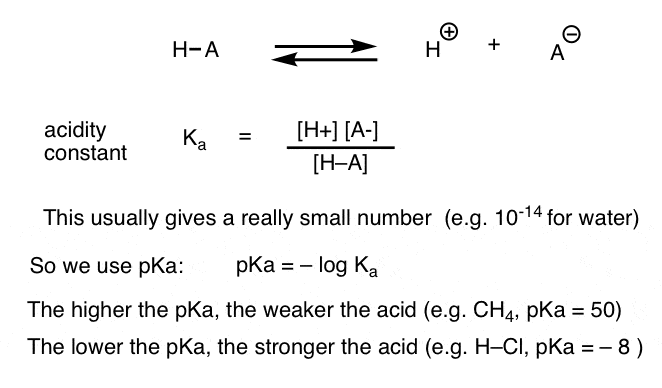
Pro větší pohodlí, používáme záporný logaritmus Ka, tzv. pKa, která je podobná známé pH stupnice, ale může přesahovat 14 protože to není přísně omezena na vodné rozpouštědlo. hodnoty pKa se pohybují od -10 nebo tak pro velmi silné kyseliny (např. kyselina jodovodíková, H-I) do 50 a více pro určité uhlovodíky (např. Ethan).
Jak můžeme použít tyto pojmy k měření zásaditosti? Nemohli bychom přejít věci kolem a definovat pojem, Kb, což je rovnovážná pro, jak snadno a druhů kombinuje s H+ , definovat pKb jako její záporný logaritmus, a porovnat základny při pohledu na jejich pKb hodnoty?
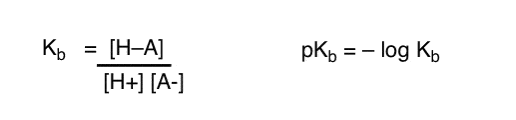
Ano…. mohli bychom. Asi jo. Kdybychom museli. Obecně je však názor organických chemiků na toto téma „šroub pKb“.
koneckonců, hodnoty pKa byly měřeny pro tisíce organických molekul. Opravdu si někdo chce pamatovat také obrovskou sadu hodnot pKb? Sakra ne!
místo toho můžeme snadno použít hodnoty pKa jako nepřímé měření bazicity. Tady je návod.
3. Pomocí pKa Hodnoty Kvantifikovat Basicity Aminů
Připomeňme si tyto dva nesmrtelné linie prózy, třeba recitovat pro sebe noční:
- čím silnější Je kyselina, tím slabší je konjugovaná báze.
- čím slabší je kyselina, tím silnější je konjugovaná báze.
byla změřena pKa pro konjugovanou kyselinu pyridinu („pyridinium“). Je to asi 5,2 .
máme také hodnotu pro pKa pro konjugovanou kyselinu piperidinu. Kolem 11 .
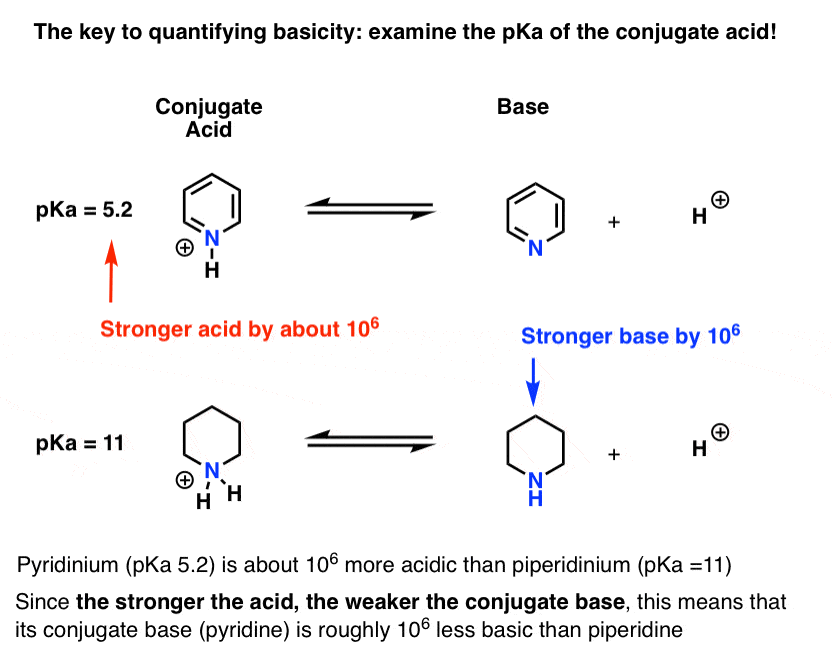
tyto hodnoty pKa, můžeme říci, že konjugát kyseliny pyridin je silnější než konjugovaná kyselina piperidine asi o 6 pKa jednotek. Protože každá jednotka pKa představuje faktor 10, je to faktor asi 1 milion.
protože“ čím silnější je kyselina, tím slabší je konjugovaná báze“, je pyridin slabší bází než piperidin o faktor 1 milion.
4. „PKa Konjugovaná Kyselina“ Může Být Zkráceně jako „pKaH“
termín, „pKa konjugovaných kyselin“ je trochu sousto pro použití na pravidelném základě. Být přirozeně líný, rádi bychom to trochu kondenzovali pro běžné použití.
protože konjugovaná kyselina báze („B“) je „BH“, můžeme zkrátit „pKa konjugované kyseliny báze“ jako její pKaH.
To nám umožňuje říci, že pKaH pyridinu je 5.2, a pKaH z piperidine je 11.
pak můžeme sáhnout do literatury, abychom našli další základy, se kterými ji porovnáme.
například, jak zásaditý je amoniak (NH3) ? Konjugovaná kyselina amoniaku, NH4 (+), je 9,2 . Ekvivalentně můžeme říci, že pKaH amoniaku je 9,2. To ji staví mezi pyridin a piperidin na stupnici bazicity.
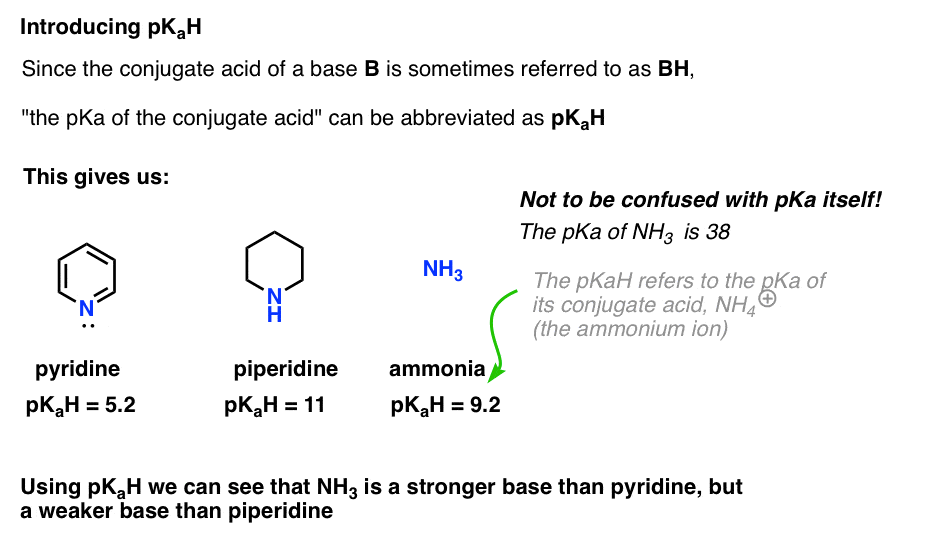
Všimněte si, že je velmi důležité nezaměňovat pKa s pKa. PKaH amoniaku je 9,2, který měří kyselost jeho konjugované kyseliny, NH4 (+).
pKa samotného amoniaku je 38, Což měří rovnovážnou konstantu pro disociaci NH3 za vzniku jeho konjugované báze, NH2(-) a H+.
to znamená, Že 38 je pKaH z ion amidový NH2(–), které jste možná setkali, než jako silná báze (NaNH2) používá se k deprotonate terminálu alkynů (pKa =25). Pomocí pKaH můžeme určit, že NH2 ( – ) je asi (38-9) = 29 řádů zásadnější než NH3 !
5. Použití pKaH k určení relativních základů aminů
použití pKaH k určení relativních sil bází je docela užitečný trik.
zde jsou některé reprezentativní příklady molekul obsahujících dusík. Níže je pKa jejich konjugovaných kyselin.
jaká je zde nejsilnější základna? Co je nejslabší?
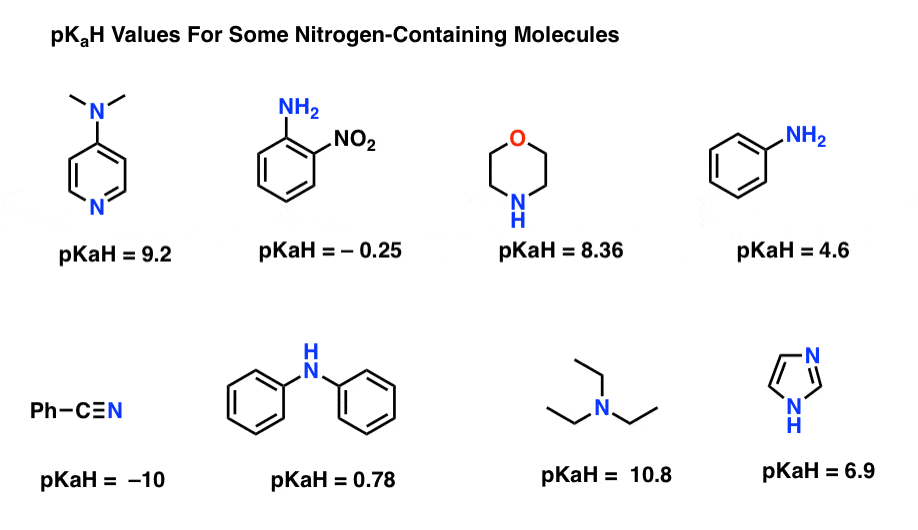
nejnižší pKaH hodnota zde je -10 pro nitril (vlevo dole). To znamená, že nitril je nejméně zásaditý ze všech těchto molekul.
nejvyšší hodnota pKaH je zde 10,8 pro triethylamin. Díky tomu je triethylamin nejsilnější základnou ze všech uvedených.
několik Slov, Upozornění Na Hodnoty pKa Pro Aminy
Dvě věci dávat pozor, zejména při čtení dalších on-line zdrojů na toto téma.
nejprve jsou někdy hodnoty pKa pro aminy hlášeny jako hodnoty pKa bez vysvětlení. Nejlepší tabulky pKa to neudělají,ale je těžké třídit pšenici z plev, když právě začínáte.
Pokud vidíte anomálně nízkou hodnotu pKa pro Amin, pravděpodobně se jedná o pKa konjugované kyseliny.
zde je například tabulka pKa, kde je pKa methylaminu (CH3NH2) uvedena jako 10.63.
to je málo. Doufejme, že v tomto bodě by vám taková hodnota 10 pro pKa Aminu měla připadat jako divná, zejména proto, že pKa blízce příbuzného NH3 je 38.
hodnota 10,63 se ve skutečnosti týká pKa konjugované kyseliny methylaminu, nikoli samotného methylaminu. Je to hodnota pKaH.
podobně stejná tabulka uvádí trimethylamin jako pKa 9,8 . Znovu, toto je vlastně jeho pKaH. Nemůžu najít skutečnou hodnotou pKa pro trimethylamin, ale tipoval bych, že to je >40, protože konjugovaná báze trimethylamin je carbanion (CH3)2N–CH2(–) ).
druhý, méně společný zdroj zmatku je, že někdy pKaH z amine se uvádí jako jeho pKb, jako v této tabulce, která uvádí pKb NH3 jako 9.2 . To je nepřesné.
Opět platí, že hodnoty pKb se v vysokoškolské organické chemii moc neobjevují, i když mi bylo řečeno, že se někdy objevují na DAT / MCAT.
7. Jaké Klíčové Faktory Řídí Zásaditost Aminů?
Nyní, když jsme se naučili alespoň kvantifikovat a interpretovat hodnoty pKa aminů a jejich konjugovaných kyselin, můžeme začít klást klíčovou otázku: proč? Jaké klíčové faktory řídí zásaditost aminů? Jaké jsou důležité trendy?
proč je například pyridin slabší bází než piperidin? Proč jsou nitrily ještě slabší? Proč mají skupiny odebírající elektrony tendenci vytvářet aminy slabší báze?
dobrou zprávou je, že pokud již rozumíte faktorům, které řídí kyselost, musíte jednoduše aplikovat přesně stejné zásady – ale naopak!
pokryjeme to v dalším příspěvku. Pět faktorů, které ovlivňují zásaditost aminů
poznámky
poznámka pod čarou 1. Existuje mnoho kyselin, které jsou non-základy (jako NH4 který postrádá osamělý pár) a mnoho základen, které jsou non-kyseliny, jako je Cl(–), která je schopna přijmout osamělý pár. Proto je špatné říkat „čím silnější je kyselina, tím slabší je báze“.
poznámka pod čarou 2. To je měření získané pomocí vody jako rozpouštědla. Můžete vidět další hodnotu, 3.4, která se získá, když se jako rozpouštědlo použije dimethylsulfoxid (DMSO). Viz Bordwell pKa tabulky (DMSO)