Basicidad de las Aminas Y pKaH
Cuantificando La Basicidad De Las Aminas, Utilizando «El pKa Del Ácido Conjugado», también conocido como «pKaH»
¿Cómo se mide la basicidad de una amina? Ejemplo de ello: ¿cuál es una base más fuerte: piridina o piperidina?
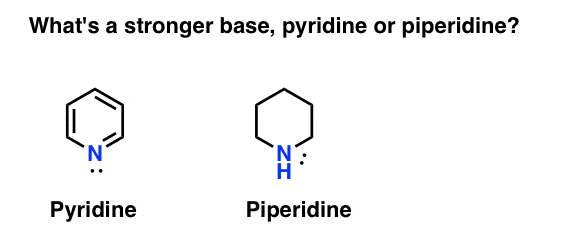
Si ha dicho piperidina, felicitaciones, es de hecho una base más fuerte.
Pero ¿por qué? Y cuánto más fuerte? ¿Cómo se intenta responder a estas preguntas? Después de todo, podemos comparar fácilmente la fuerza de los ácidos examinando sus pKa. ¿No deberíamos ser capaces de hacer lo mismo con las bases?
Sí, en cierto modo. Aquí hay dos puntos clave para hoy:
- La mejor manera de cuantificar la basicidad de una amina es examinar el pKa de su ácido conjugado.
- Cuanto mayor sea el pKa del ácido conjugado, más fuerte será la base.
En este post mostraremos algunos ejemplos específicos de cómo usar los valores de pKa para comparar la basicidad de las aminas.
En un post posterior, exploraremos algunas tendencias clave subyacentes a la basicidad de las aminas.
Tabla de Contenidos
- Revisión Rápida: Ácidos, Bases, Ácidos Conjugados y Bases Conjugadas
- Usando pKa Para Medir La Acidez
- Usando pKa Para Cuantificar La Basicidad De Las Aminas
- El «pKa Del Ácido Conjugado» Se Puede Abreviar Como «pKaH»
- Usando pKaH Para Determinar Las Basicidades Relativas De Las Aminas
- Valores De pKa Para Aminas
- ¿Qué Factores Clave Rigen La Basicidad De Las Aminas?
- Notas
1. Revisión Rápida: Ácidos, Bases, Ácidos Conjugados y Bases Conjugadas
Primero, repasemos rápidamente algunos conceptos básicos de basicidad.
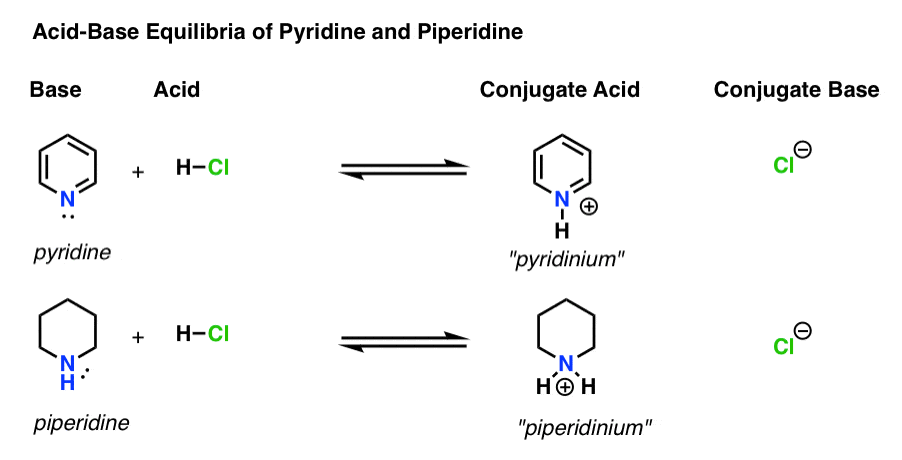
Hay cuatro actores en cada reacción ácido-base.
- La base es la especie que dona un par solitario a H+ (también conocido como «protón» o «núcleo de hidrógeno»). Es donde se forma el nuevo enlace a H (por ejemplo, piridina, a continuación)
- El ácido conjugado es la especie que resulta después de que la base forma un enlace a H (por ejemplo, «piridinio», que tiene un nuevo enlace N–H)
- El ácido es la especie que pierde H+ . Es donde se rompe el vínculo con H (p. ej. H-Cl)
- La base conjugada es la especie que permanece después de que el ácido dona H+ a la base (por ejemplo, Cl-)
Aquí están la piridina y la piperidina en acción. Siguiendo los lazos que se forman y rompen, puede identificar a cada actor.
2. Usando pKa Para Medir la acidez
Cada reacción ácido-base se puede escribir como un equilibrio entre una reacción hacia adelante y hacia atrás. Hemos visto que la constante de acidez, Ka, es una medida de la facilidad con que una especie se disocia para dar H+ y la base conjugada.
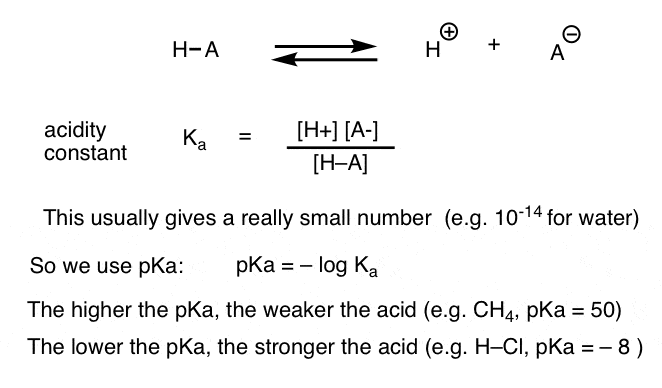
Para mayor comodidad, usamos el log negativo de Ka, llamado pKa, que es similar a la escala de pH familiar, pero puede extenderse más allá de 14 porque no está estrictamente limitado al disolvente acuoso. Los valores de pKa van de -10 aproximadamente para ácidos muy fuertes (por ejemplo, ácido hidroiódico, H–I) a 50 o más para determinados hidrocarburos (por ejemplo, etano).
¿Cómo podemos aplicar estos conceptos para medir la basicidad? ¿No podríamos cambiar las cosas y definir un término, Kb, que es el equilibrio de cuán fácilmente una especie se combina con H+, definir pKb como su logaritmo negativo y comparar bases mirando sus valores de pKb?
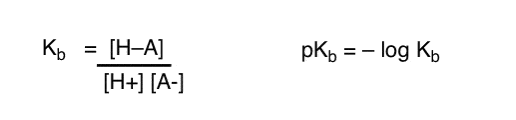
Sí…. podríamos. Supongo. Si tuviéramos que hacerlo. Pero en general, la opinión de los químicos orgánicos sobre este tema es «Tornillo pKb».
Después de todo, los valores de pKa se han medido para miles de moléculas orgánicas. ¿Alguien realmente quiere tener que recordar un gran conjunto de valores pKb también? ¡Diablos, no!
En su lugar, podemos usar fácilmente los valores de pKa como una medición indirecta de la basicidad. He aquí cómo.
3. Usando Valores de pKa Para Cuantificar la Basicidad de las Aminas
Recuerde estas dos líneas inmortales de prosa, que vale la pena recitarse todas las noches:
- Cuanto más fuerte es el ácido, más débil es la base conjugada.
- Cuanto más débil es el ácido, más fuerte es la base conjugada.
Se ha medido el pKa del ácido conjugado de piridina («piridinio»). Son como 5,2 .
También tenemos un valor para el pKa para el ácido conjugado de piperidina. Son las 11 .
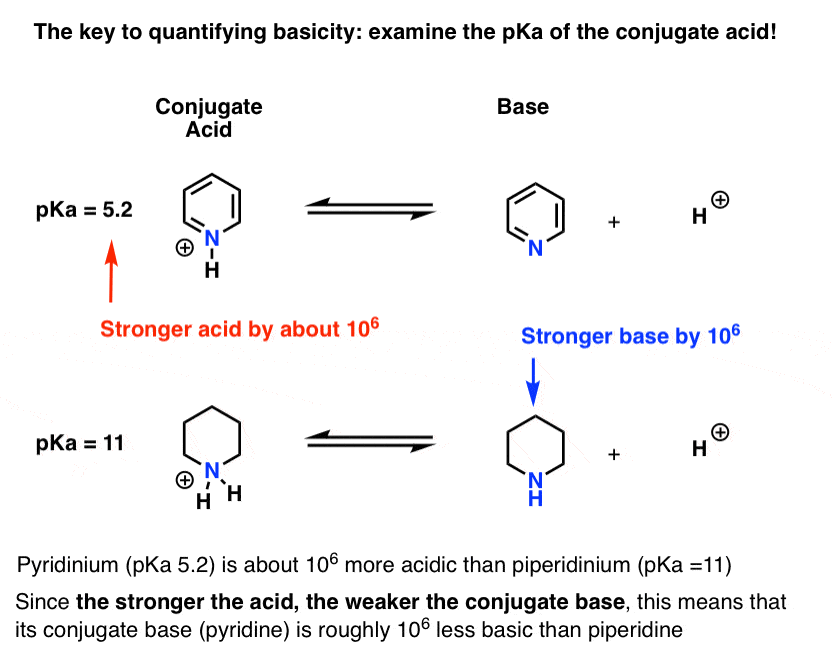
De estos valores de pKa, podemos decir que el ácido conjugado de piridina es más fuerte que el ácido conjugado de piperidina en aproximadamente 6 unidades de pKa. Dado que cada unidad pKa representa un factor de 10, eso es un factor de aproximadamente 1 millón.
Dado que «cuanto más fuerte es el ácido, más débil es la base conjugada», la piridina es, por lo tanto, una base más débil que la piperidina por un factor de 1 millón.
4. «El pKa Del Ácido Conjugado «Se puede Abreviar como»pKaH»
El término, «pKa del ácido conjugado» es un poco complicado de usar de forma regular. Siendo naturalmente perezosos, nos gustaría condensar esto un poco para uso común.
Dado que el ácido conjugado de una base («B») es «BH», podemos abreviar «el pKa del ácido conjugado de una base» como su pKaH.
Esto nos permite decir que el pKaH de la piridina es 5,2, y el pKaH de la piperidina es 11.
Luego podemos indagar en la literatura para encontrar otras bases con las que compararla.
Por ejemplo, ¿qué tan básico es exactamente el amoníaco (NH3) ? El ácido conjugado del amoníaco, NH4 (+), es 9.2 . De manera equivalente, podemos decir que el pKaH de amoníaco es 9.2. Esto la coloca entre la piridina y la piperidina en la escala de basicidad.
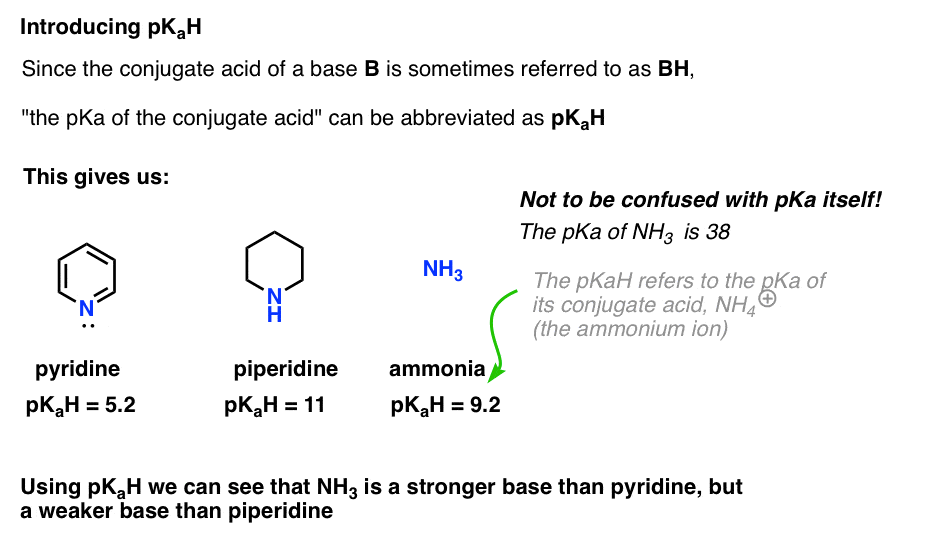
Tenga en cuenta que es muy importante no confundir pKaH con pKa. El pKaH del amoníaco es 9.2, que mide la acidez de su ácido conjugado, NH4(+).
El pKa del amoníaco en sí es 38, que mide la constante de equilibrio para la disociación de NH3 para dar su base conjugada, NH2 ( -) y H+.
Eso significa que 38 es el pKaH del ion amida NH2 (–), que puede haber encontrado antes como la base fuerte (NaNH2) utilizada para desprotonar alquinos terminales (pKa =25). Usando pKaH, podemos determinar que NH2 (–) es aproximadamente (38 – 9) = 29 órdenes de magnitud más básica que NH3 !
5. Usar pKaH para Determinar Las Basicidades Relativas De Las Aminas
Usar pKaH para determinar las fortalezas relativas de las bases es un truco bastante útil.
Aquí hay algunos ejemplos representativos de moléculas que contienen nitrógeno. A continuación se muestra el pKa de sus ácidos conjugados.
¿Cuál es la base más fuerte aquí? ¿Cuál es el más débil?
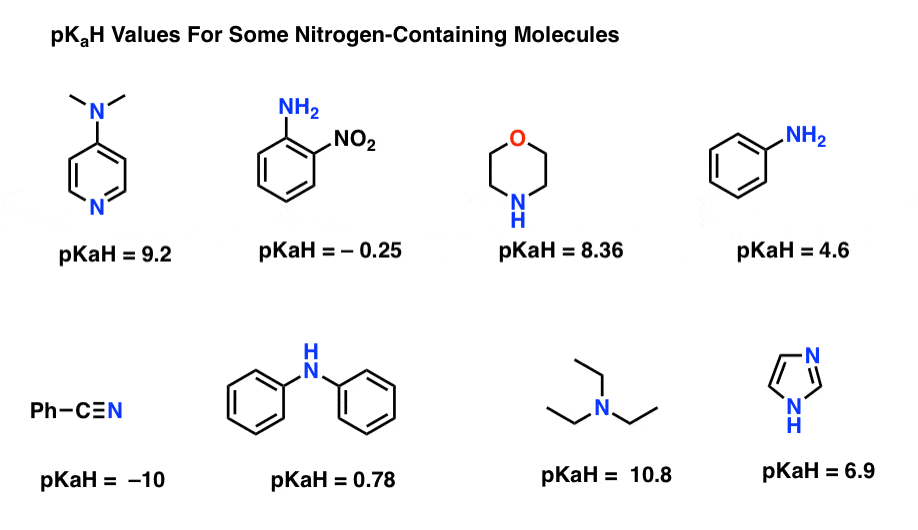
El valor de pKaH más bajo aquí es -10 para el nitrilo (abajo a la izquierda). Esto significa que el nitrilo es la menos básica de todas estas moléculas.
El valor pKaH más alto aquí es 10,8 para la trietilamina. Eso hace que la trietilamina sea la base más fuerte de todas las enumeradas.
Algunas Palabras De Precaución Sobre Los Valores de pKa Para Aminas
Dos cosas a tener en cuenta, especialmente al leer otras fuentes en línea sobre este tema.
En primer lugar , a veces los valores de pKaH para aminas se reportan como valores de pKa, sin explicación. Las mejores mesas de pKa no harán esto, pero es difícil separar el trigo de la paja cuando recién estás comenzando.
Si ves un valor de pKa anómalo bajo para una amina, es probable que se refiera al pKaH del ácido conjugado.
Por ejemplo, aquí hay una tabla de pKa donde el pKa de metilamina (CH3NH2) aparece como 10.63.
Eso es bajo. Esperemos que en este punto, tal valor de 10 para un pKa de una amina le parezca extraño, especialmente porque el pKa del NH3 estrechamente relacionado es 38.
El valor de 10.63 en realidad se refiere al pKa del ácido conjugado de metil amina, NO a la metilamina en sí. Es un valor pKaH.
De manera similar, en la misma tabla se indica que la trimetilamina tiene un pKa de 9,8 . De nuevo, esto es en realidad su pKaH. No puedo encontrar un valor pKa real para la trimetilamina, pero supongo que es >40, ya que la base conjugada de la trimetilamina es el carbanión (CH3)2N–CH2(–) ).
Una segunda fuente de confusión, menos común, es que a veces la pKaH de una amina es reportada como su pKb, como en esta tabla que reporta la pKb de NH3 como 9.2 . Esto es inexacto.
De nuevo, los valores de pKb realmente no surgen mucho en química orgánica de pregrado, aunque me dicen que a veces aparecen en el DAT/MCAT.
7. ¿Qué Factores Clave Gobiernan La Basicidad De Las Aminas?
Ahora que hemos aprendido al menos a cuantificar e interpretar los valores de pKa de las aminas y sus ácidos conjugados, podemos comenzar a hacernos la pregunta clave: ¿por qué? ¿Qué factores clave gobiernan la basicidad de las aminas? ¿Cuáles son las tendencias importantes?
Por ejemplo, ¿por qué la piridina es una base más débil que la piperidina? ¿Por qué los nitrilos son bases aún más débiles? ¿Por qué los grupos que retiran electrones tienden a hacer que las aminas sean bases más débiles?
La buena noticia es que si ya entiendes los factores que rigen la acidez, simplemente tienes que aplicar exactamente los mismos principios, ¡pero al revés!
Cubriremos eso en el próximo post. Cinco Factores Que Afectan La Basicidad de las Aminas
Notas
Nota 1. Hay muchos ácidos que no son bases (como NH4, que carece de un par solitario) y muchas bases que no son ácidos, como Cl (-), que es incapaz de aceptar un par solitario. Por lo tanto, decir «cuanto más fuerte es el ácido, más débil es la base» es incorrecto.
Nota 2. Esa es la medición obtenida usando agua como disolvente. Es posible que vea otro valor, 3.4, que se obtiene cuando se usa dimetilsulfóxido (DMSO) como disolvente. Ver Tablas Bordwell pKa (DMSO)